
相同物质的量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3 C.AlCl3 Al2O3
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:实验题
(18分)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为______________________。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)能说明氧化性Fe3+>SO2的离子方程式是______________________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| | 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
 FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校研究小组为探究KI溶液的pH与其在空气之中氧化变质的关系,进行了相应的实验探究。
【提出假设】
假设1:只有碱性环境下能被氧化
假设2:只有酸性环境下能被氧化
假设3:只有中性环境下能被氧化
假设4: 能被氧化
【实验探究】
(1)有人认为由于I2会和KOH反应,因此否定假设1。小组同学认为,若溶液的碱性较弱时,I2不会反应。为了验证滚点,小组同学进行了下述实验:
在编号为①②③的试管中加入相同量的碘的淀粉溶液中,然后分别加入pH为9、10、11的KOH溶液,发现试管①中蓝色不消失,试管②③中蓝色消失。
由此可以得出结论: 。
(2)为探究KI溶液在不同碱性条件下能否被氧气氧化,小组同学设计了以下实验:将下表中的药品分别加入到试管中,然后放置于收集有氧气的储气瓶中,塞上塞子,观察现象。完成以下实验设计表(表中不要留空格)。
| 实验编号 | 蒸馏水 | 淀粉溶液 | KI固体 | 稀KOH溶液 | 一段时间后观察实验现象 |
| 1 | 30mL | 2 mL | 5g | 0滴 | 试管中出现了蓝色 |
| 2 | 29.5 mL | | 5g | 10滴 | 试管中出现了很浅的淡蓝色 |
| 3 | 29 mL | 2 mL | | 20滴 | 试管中无明显变化 |
| 4 | | 2 mL | 5g | 30滴 | |
| 实验方案(不要求写具体过程) | 预期实验结果和结论 |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为
A.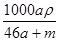 mol·L-1 mol·L-1 | B.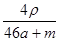 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 | D.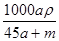 mol·L-1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有些地区水井中的水刚抽出时清澈透明,烧开后却产生了红褐色的不溶物。某研究性学习小组对这种现象进行了分析:向刚抽出的井水中加入硫氰化钾溶液,无明显现象;向产生不溶物的水中加入盐酸,不溶物溶解,再向其中加入硫氰化钾溶液,溶液呈现血红色。下列说法不正确的是
| A.该井水中肯定有Fe3+ | B.该井水中肯定有Fe2+ |
| C.红褐色不溶物是Fe(OH)3 | D.红褐色的不溶物受热可以分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼
金属铝。下列说法不正确的是( ) 
| A.①、②中除加试剂外,还需要进行过滤操作 |
| B.a、b中铝元素的化合价相同 |
| C.③中需要通入过量的氨气 |
| D.④进行的操作是加热,而且d一定是氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于Na、Mg及其化合物的说法正确的是
| A.钠在空气中燃烧生成Na2O |
| B.点燃的镁条在CO2中燃烧,生成氧化镁和碳 |
| C.钠保存在酒精中是因为酒精不与钠发生反应,且酒精的密度比钠小 |
| D.足量稀HCl加入Mg(OH)2沉淀中,加热蒸干得无水MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作能达到预期实验目的的是
| | 实验目的 | 实验操作 |
| A | 鉴别Al3+和Fe3+ | 分别加入过量NaOH溶液 |
| B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
| C | 证明品红溶液褪色的原因是通入了SO2 | 将褪色后的溶液再加热 |
| D | 分离乙酸乙酯和乙酸 | 加饱和NaOH溶液,蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com