
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
 (1)下列是部分金属元素的电离能
(1)下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
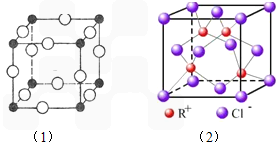
 (2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
(2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
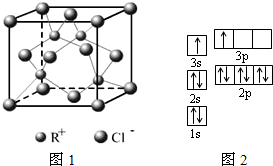
 确定物质性质的重要因素是物质结构.请回答下列问题.
确定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | KCl | MgO | CaO |
| 晶格能/kJ?mol-1 | 715 | 3791 | 3401 |
| C | 2- 2 |
| O | 2+ 2 |
| O | 2+ 2 |


| O | 2+ 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
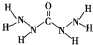 能除去锅炉水中溶解的氧气,下列说法正确的是( )
能除去锅炉水中溶解的氧气,下列说法正确的是( )| A、A分子中所有原子都在同一平面内 | B、A分子中所含的O-键与π键个数之比为10:1 | C、1 mol A所含有的电子数为44NA(NA表示阿伏伽德罗常数) | D、1 molA与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com