
化学平衡可归纳为如下特征:
(1)逆:研究对象必须是________反应.
(2)动:化学平衡是________平衡,即当反应达到平衡时,正反应和逆反应仍都在进行.
(3)等:正反应速率和逆反应速率________.
(4)定:反应混合物中,各组分的________或________保持一定.
(5)变:化学平衡状态是有条件的、相对的、暂时的,改变影响平衡的条件,平衡会被________,直至达到新的平衡.
科目:高中化学 来源: 题型:

请根据表回答下列问题:
(1)硒的熔点范围可能是_____________。
(2)碲的化合价可能有_____________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱顺序是_____________(填化学式)。
(4)氢硒酸有较强的(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为____________________________________。
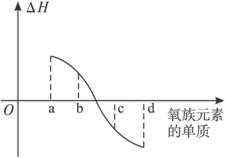
(5)下图所示为氧族元素单质与H2反应过程中的能量变化(ΔH)示意图,其中a、b、c、d分别表示氧族中某一元素的单质,ΔH为相同物质的量的单质与H2反应的反应热。则:b代表___________(写单质名称)。
(6)硫的最高价含氧酸(H2SO4)是一种用途广泛的化学试剂。工业大量生产时通常要经过①含硫物质的氧化 ②SO2催化氧化成SO3 ③SO3的吸收三个主要过程。已知SO2的催化氧化是一个放热的可逆反应,该反应化学平衡常数(K)的表达式为_______________________,为提高SO2的转化率,试写出两种可以采用的措施:_____________________________;_______________________________。吸收SO3时若反应过快会形成酸雾,则是否可以用水直接吸收?________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com