
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

对上述流程中的判断正确的是 ( )
A.试剂X可以为氨水,沉淀中含有铁的化合物
B.CO2可以用H2SO4溶液或稀盐酸代替
C.反应Ⅱ中的反应为CO2+[Al(OH)4]-===Al(OH)3↓+HCO
D.工业上还可采用Fe还原Al2O3的方法制Al,成本更低
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的物质是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3
A.全部 B.①②③ C.①②③⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E为短周期主族元素,它们的原子序数依次增大。请回答下列问题。
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D | 元素的主族序数与周期数的差为3 |
| E | 元素是该周期电负性最大的元素 |
(1)B基态原子中能量最高的电子,其电子云在空间有 个伸展方向,原子轨道呈 形。B与A能形成多种形式的化合物,其中BA5属于离子晶体,其电子式为 。
(2)C的单质在一种常见的非金属氧化物中剧烈燃烧生成黑、白两种固体,写出该反应的化学方程式 ;其中的白色固体可用作耐火材料,它属于 晶体。
(3)BE3 在常温下是一种淡黄色的液体,构成其晶体的微粒之间的作用力是 ,它遇水即发生水解可生成一种具有漂白性的物质,写出反应的化学方程式 ,该反应说明其中B和E中非金属性较强的是 (填元素的符号)。
(4)DO2气体通入足量Ba(BO3)2的溶液,生成白色沉淀和无色气体,有关反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某氧化物X难溶于水,能与烧碱反应,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中无沉淀生成,则X是 ( )
A.SiO2 B.Al2O3
C.MgO D.CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.向氯化铝溶液中通入过量氨气:4NH3+Al3++4H2O===[Al(OH)4]-+4NH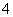
B.将铝片打磨后置于NaOH溶液中:2Al+2OH-+2H2O===2[Al(OH)4]-+H2↑
C.向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO +2Ba2++4OH-===2BaSO4↓+[Al(OH)4]-
+2Ba2++4OH-===2BaSO4↓+[Al(OH)4]-
D.向Na[Al(OH)4]溶液中通入足量CO2:2[Al(OH)4]-+CO2===2Al(OH)3↓+CO +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:

②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

回答下列问题:
(1)写出反应1的化学方程式_______________________________________________。
(2)滤液Ⅰ中加入CaO生成的沉淀是________,反应2的离子方程式为____________。
(3)E可作为建筑材料,化合物C是________,写出由D制备冰晶石的化学方程式________________________________________________________________________。
(4)电解法制铝的化学方程式是________,以石墨为电极,阳极产生的混合气体的成分是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、NH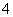 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO 、SO
、SO 、NO
、NO 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的 量之间的关系如图所示。则下列说法正确的是 ( )
量之间的关系如图所示。则下列说法正确的是 ( )
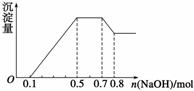
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH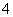 )=0.2 mol
)=0.2 mol
C.溶液中一定不含CO ,可能含有SO
,可能含有SO 和NO
和NO
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质与氢键无关的是 ( )
A.冰的密度比液态水的密度小 B.乙醇能跟水以任意比混溶
C.NH3 分子比PH3 分子稳定 D.在相同条件下,H2O的沸点比H2S的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
迷迭香酸是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,其结构如下图所示。
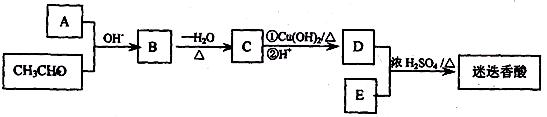
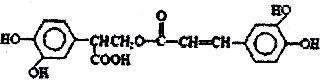 某同学设计了迷迭香酸的合成线路:
某同学设计了迷迭香酸的合成线路:
已知:①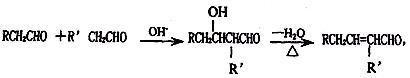
 、
、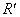 表示烃基或氢原子;
表示烃基或氢原子;
②苯环上的羟基很难直接与羧酸发生酯化反应。
(1)A的分子式为___________
(2)C的结构简式为___________
(3)D、E反应的化学方程式为_____________________
(4)与E互为同分异构体且同时满足下列条件的有机物有____ 种。
①苯环上共有四个取代基,且苯环上只有一种化学环境的氢原子;
②1mol该同分异构体分别与NaHCO3、NaOH反应时,最多消耗NaHCO3、NaOH的物质的量分别是1mol、4mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com