
【题目】高铁酸钾(K2FeO4)是优良的多功能、绿色水处理剂。制备高铁酸钾的装置如图:
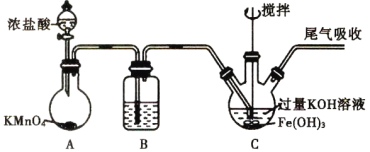
资料:①K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中比较稳定。②制备K2FeO4的反应为放热反应。下列叙述正确的是
A.装置A中的KMnO4可以用MnO2代替
B.装置B中的试剂为饱和碳酸氢钠溶液,目的是除去C12中的HC1
C.装置C中生成K2FeO4的关键操作是要缓慢通入Cl2且不能过量
D.K2FeO4做水处理剂时能杀菌消毒、吸附悬浮物与Cl2作用相同
【答案】C
【解析】
装置A为氯气的制备装置,装置B除去氯气中混有HCl气体,氯气进入装置C后与KOH和Fe(OH)3混合溶液反应制备高铁酸钾。
A.MnO2与浓盐酸制备氯气需要加热,该装置没有加热装置,所以不能用二氧化锰代替高锰酸钾,故A错误;
B.饱和碳酸氢钠会和HCl反应生成二氧化碳,二氧化碳可以和KOH反应,影响高铁酸钾的制备,故B错误;
C.氯气通入速率过快反应过快方出大量的热,会使高铁酸钾分解,而氯气过量会使溶液显酸性,从而造成高铁酸钾的分解,故C正确;
D.K2FeO4具有强氧化性,能杀菌消毒,能产生Fe3+从而生成氢氧化铁胶体吸附杂质,氯气消毒并不能吸附杂质,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
①写出NO2和NH3反应生成N2和液态水的热化学反应方程式______。
②反应Ⅰ中各物质所含化学键键能总和数据如下表,a=______。
物质 | N2 | O2 | NO |
每摩尔物质所含键能总和/kJ·mol-1 | 946 | 498 | 630 |
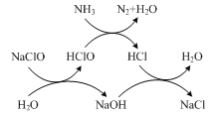
(2)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为______。
(3)某微生物膜技术能利用电解原理将弱碱性水中的NO![]() 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
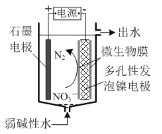
①写出阴极的电极反应式:______。
②理论上,若除去0.04 mol NO![]() ,阳极生成气体的体积为______。(标准状况)
,阳极生成气体的体积为______。(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
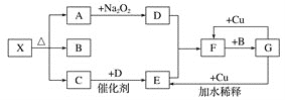
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是( )
A.煅烧粉碎的黄铁矿矿石有利于SO2的生成
B.合成氨工业中使用铁触媒做催化剂
C.用饱和食盐水除去氯气中氯化氢杂质
D.容器中有2NO2(g)![]() N2O4(g),增大压强颜色变深
N2O4(g),增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X是金属元素,W、Y是不同主族的非金属元素且最外层电子数为偶数,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如下图所示。下列叙述正确的是
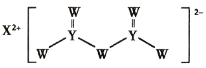
A.W、X离子半径比较:X>W
B.Y、Z的氢化物稳定性比较:Y>Z
C.1mol YW2晶体中含有4mol Y—W键
D.工业上可通过电解熔融XW来生产X的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业合成的常用氧化剂和催化剂,如图所示的微生物电池,能利用K2Cr2O7实现对含苯酚(或醛类)废水的有效处理,该电池工作一段时间后,中间室内的NaC1溶液浓度减小,则下列叙述正确的是

A.a电极为负极,电子从a电极经过中间室到达b电极
B.M为阳离子交换膜,电解过程中中间室内的n(NaC1)减小
C.处理含苯甲醛废水时a电极反应式为:C6H5CHO-32e-+13H2O=7CO2+32H+
D.当b电极消耗等物质的量的K2Cr2O7时,a电极消耗的C6H5OH或C6H5CHO的物质的量之比为8:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。
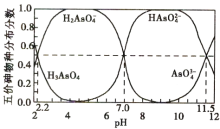
下列叙述错误的是
A.将NaOH溶液逐滴加入到H3AsO4溶液中,当溶液pH在5~6时发生反应的离子方程式为![]()
B.Na2HAsO4溶液中离子浓度关系c(Na+)>c(HAsO![]() )>c(OH-)>c(H2AsO
)>c(OH-)>c(H2AsO![]() )>c(AsO
)>c(AsO![]() )
)
C.向H3AsO4溶液滴加NaOH溶液至中性时c(Na+)=2c(HAsO![]() )+3c(AsO
)+3c(AsO![]() )
)
D.AsO43-第一步水解的平衡常数的数量级为10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3molA和1molB混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生如下反应:3A(g)+B(g)![]() 2C(g)+D(g),达到平衡时C的浓度为wmol/L。回答下列问题:
2C(g)+D(g),达到平衡时C的浓度为wmol/L。回答下列问题:
(1)保持温度和压强不变,按下列四种配比充入容器P中有关物质,平衡后C的浓度仍为wmol/L的是___。
A.6molA+2 molB B.3molA+1molB+2molC
C.2molC+1molB+1molD D.1molC+2molD
(2)保持原起始温度和体积不变,要使平衡后C的浓度仍为wmol/L,应按下列哪种配比向容器Q中充入有关物质___。
A.3molA+1 molB
B.4molC+2molD
C.1.5molA+0.5molB+1molC+0.5molD
D.无法判断
(3)保持原起始温度和体积不变,若仍按3molA和1molB配比在容器Q中发生反应,则平衡时C的浓度和wmol/L的关系是___。
A.大于wmol/L B.小于wmol/L C.等于wmol/L D.无法比较
(4)将2molC和2molD按起始温度和压强充入容器Q中,保持温度和体积不变,平衡时C的浓度为vmol/L,则v和w的关系是___。
A.v>w B.v<w C.v=w D.无法比较
(5)将题干中的体积可变的密闭容器P改为恒容条件,在某温度下,将2.4molA和0.8molB混合于该容器中发生上述反应,达到平衡时C的物质的量为nmol。若A、B、C、D起始的物质的量分别用a、b、c、d表示,保持恒温恒容,要使反应开始时向逆反应进行,且达到平衡后C的物质的量仍为n mol,则起始时C的物质的量取值范围是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜、铁、铝等在人类文明史上先后被广泛使用。回答下列问题:
(1)铜、银、金三种金属在元素周期表同族且依次相邻,因此价电子层结构相似。银原子价层电子排布式为________;金元素在周期表的位置是________。
(2)观察如下循环图可以获知FeO的晶格能为________ kJ·mol-1。

(3)氯化铝熔点194℃,会升华,熔融态不易导电。实验测得气态氯化铝分子组成式为Al2Cl6,其结构式为________;气态氯化铝中存在________(填选项标号)
A.离子键 B.配位键 C.氢键 D.范德华力 E.金属键 F.非极性共价键
(4)石墨微观结构如下图。其中碳原子杂化类型为________。金刚石晶体中碳碳键键长为0.155nm。金刚石的熔点略低于石墨,而远高于C60的原因是________。
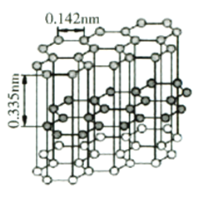
(5)设阿伏加德罗常数值为NA,则石墨的密度为________![]() (列出计算表达式)
(列出计算表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com