
 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X.为确定其组成,进行如下实验.分析 (1)①通过2中液面调节A中压强;根据装置图可知,仪器3为分液漏斗;
②碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中;用酚酞做指示剂,滴定终点时溶液呈浅红色;
③根据氨气与和盐酸反应之间的关系式计算氨气的质量,再根据质量分数公式计算氨质量分数;若气密性不好,导致氨气的量偏低;
(2)根据离子积常数Ksp(Ag2CrO4)=c(CrO42-)•c2(Ag+)计算c(CrO42-);
(3)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,该反应中Co失电子、双氧水得电子,CoCl2•6H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水;双氧水易分解、气体的溶解度随着温度的升高而降低.
解答 解:(1)①无论三颈瓶中压强过大或过小,都不会造成危险,若过大,A在导管内液面升高,将缓冲压力,若过小,外界空气通过导管进入烧瓶,也不会造成倒吸,安全作用的原理是使A中压强稳定,根据装置图可知,仪器3为分液漏斗,
故答案为:使A瓶中压强稳定;分液漏斗;
②碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中;用酚酞做指示剂,判断达到滴定终点时的现象为溶液变为浅红色,且30秒内不褪色,
故答案为:碱;溶液变为浅红色,且30秒内不褪色;
③与氨气反应的n(HCl)=V1×10-3L×C1mol•L-1-C2mol•L-1 ×V2×10-3L=(C1V1-C2V2)×10-3mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)=(C1V1-C2V2)×10-3mol,氨的质量分数=$\frac{({C}_{1}{{V}_{\;}}_{1}-{C}_{2}V{\;}_{2})×10{\;}^{-3}×17}{w}$×100%,若气密性不好,导致部分氨气泄漏,所以氨气质量分数偏低,
故答案为:$\frac{({C}_{1}{{V}_{\;}}_{1}-{C}_{2}V{\;}_{2})×10{\;}^{-3}×17}{w}$×100%;偏低;
(2)c(CrO42-)=$\frac{Ksp}{c{\;}^{2}(Ag{\;}^{+})}$=$\frac{1.12×10{\;}^{-12}}{(2.0×10{\;}^{-5})\\;{\;}^{2}}$mol/L=2.8×10-3 mol/L,
故答案为:2.8×10-3;
(3)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,该反应中Co失电子、双氧水得电子,CoCl2•6H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水,反应方程式为2CoCl2+2NH4Cl+10NH3+H2O2$\frac{\underline{\;催化剂\;}}{\;}$2[Co(NH3)6]Cl3+2H2O;双氧水易分解、气体的溶解度随着温度的升高而降低,所以X的制备过程中温度不能过高,
故答案为:2CoCl2+2NH4Cl+10NH3+H2O2$\frac{\underline{\;催化剂\;}}{\;}$2[Co(NH3)6]Cl3+2H2O;温度越高过氧化氢分解、氨气逸出,都会造成测量结果不准确.
点评 本题考查了物质含量的测定,涉及难溶物的溶解平衡、氧化还原反应、物质含量的测定等知识点,明确实验原理是解本题关键,知道指示剂的选取方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
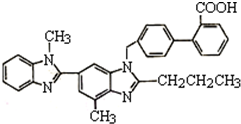 替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )| A. | 该物质属于芳香族化合物 | |
| B. | 能发生加成反应、取代反应和酯化反应 | |
| C. | 替米沙坦的分子式为C32H28O2N4 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验NH4+时,加浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝,则可证明原溶液中含有NH4+ | |
| B. | 检验SO42-时,加入BaCl2溶液,再加稀硝酸,若沉淀不消失,则可证明含SO42- | |
| C. | 用天平和小烧杯称量5.40gNaOH固体 | |
| D. | 用饱和FeCl3溶液中逐滴滴加NaOH溶液,至溶液呈红褐色即可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
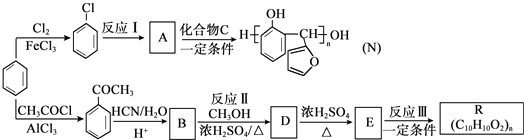

 .
. 生成
生成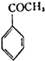 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂.
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.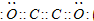 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32- )=1mol•L-1,则溶液中Na+的个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com