
| A. | 丙酸和乙酸甲酯 | B. | 淀粉和纤维素 | C. | 葡萄糖和果糖 | D. | 蔗糖和麦芽糖 |
科目:高中化学 来源: 题型:解答题
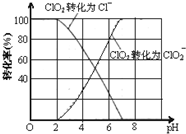 已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用.②ClO2气体在中性和碱性溶液中不能稳定存在.
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用.②ClO2气体在中性和碱性溶液中不能稳定存在.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )| A. | 催化剂a表面发生氧化反应,有O2产生 | |
| B. | 催化剂b表面的反应是CO2+2H++2e-═HCOOH | |
| C. | 催化剂a附近酸性减弱,催化剂b附近酸性增强 | |
| D. | 总的电池反应为2H2O+2CO2═2HCOOH+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Na2CO3溶液中CO32-的水解:CO32-+H2O═HCO3-+OH- | |
| C. | 用CuSO4溶液吸收H2S气体:Cu2++S2-═CuS↓ | |
| D. | 向NaOH溶液中通入过量的CO2气体:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com