
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的离子半径由大到小的顺序为__________________。(用离子符号)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________ 。(用化学式)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(4)由表中①④两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ _。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中①②两种元素可以组成多种烃,若原子也按1:1组成的常见液态化合物是重要的化工原料,也是常见的有机溶剂,写出该物质与硝酸发生反应的化学方程式: _______________。
(6)⑥的单质在⑤的最高价氧化物对应水化物中反应的离子方程式为:________________。
【答案】O2->Na+>Al3+ HNO3>H2CO3>H2SiO3 ![]() (或
(或![]() ) ab
) ab ![]() +HNO3
+HNO3![]()
![]() +H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
+H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
根据元素在周期表中的位置,可以知道①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl。
(1)离子核外电子层越多半径越大,当离子核外电子层一样多时,核电荷数越多半径越小;
(2)元素的非金属性越强,其最高价含氧酸的酸性就越强;同一周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强;
(3) NaOH、NaClO是既含离子键又含极性共价键的化合物;
(4)由表中①④两种元素的原子按1:1组成的常见液态化合物是H2O2,其分解的催化剂为MnO2、FeCl3;
(5)由表中①②两种元素分别是H、C,二者可以组成多种烃,若原子也按1:1组成的常见液态化合物是重要的化工原料,也是常见的有机溶剂,则该物质是苯,根据苯的化学性质书写苯与硝酸发生硝化反应的化学方程式。
根据元素在周期表中的分布,可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl。
(1)④、⑤、⑥表示的元素分别是O、Na、Al,三种元素形成的离子O2-、Na+、Al3+的核外电子层结构相同,对于电子层结构相同的离子,核电荷数越多,离子半径越小,所以离子半径由大到小的顺序为O2->Na+>Al3+;
(2)②、③、⑦分别表示的是C、N、Si元素,②、③是C、N,是同一周期的元素,根据元素周期律,同一周期,从左到右,元素的非金属性逐渐增强,由于元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,由于元素的非金属性N>C,所以酸性:HNO3 >H2CO3;②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3,所以这三种元素的最高价含氧酸的酸性由强到弱的顺序为:HNO3>H2CO3>H2SiO3;
(3)①④⑤⑧分别是H、O、Na、Cl,其中钠元素、氧原子、氢元素组成的氢氧化钠,钠元素、氧原子、氯元素组成的次氯酸钠,均是既含离子键又含极性共价键的化合物,NaOH的电子式为:![]() ;NaClO的电子式为
;NaClO的电子式为![]() ;
;
(4)由表中①④两种元素的原子按1:1组成的常见液态化合物是H2O2,H2O2具有氧化性,可与Na2SO3反应生成Na2SO4和H2O,H2O2具有还原性,能被KMnO4氧化生成O2,在MnO2、FeCl3催化作用下发生分解反应,产生H2O和O2,因此催化剂为MnO2、FeCl3,合理选项是ab;
(5)由表中①②两种元素分别是H、C元素,这两种元素可以组成多种烃,若原子也按1:1组成的常见液态化合物是重要的化工原料,也是常见的有机溶剂,则该物质是苯,苯与浓硝酸在浓硫酸催化作用下发生硝化反应产生硝基苯和水,则苯与硝酸发生硝化反应的化学方程式为:![]() 。
。
(6)⑥是Al,⑤是Na,Al元素的的单质在⑤的最高价氧化物对应水化物NaOH溶液中发生反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A. 粗硅![]() SiCl4
SiCl4![]() Si
Si
B. Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
C. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
D. S![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol/L的CH3COOH溶液加水稀释或升高温度的过程中,下列表达式的数值一定变大的是( )
A. c(H+) B. c(H+)·c(OH-) C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
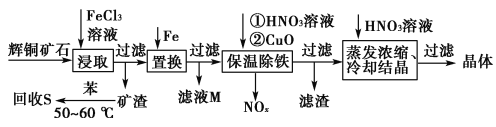
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:______________________________________________________________。
(2)“回收S”过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是______________________________________________________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为_________________________________________________;
向滤液M中加入(或通入)________(填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“保温除铁”过程中,加入CuO的目的是__________;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W的原子结构示意图为________。
(2)A、W两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。用电子式表示化合物D2W的形成过程______________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X的最高价氧化物对应水化物与其简单气态氢化物所形成的化合物中含有的化学键类型是_______
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A1-MnO4电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示。已知电池总反应为Al + MnO4 ═AlO2- + MnO2.下列说法正确的是( )

A. 电池工作时,K+向负极移动
B. 电池工作时,电子由Al经电解质溶液流向Ni
C. 负极反应为Al- 3e + 4OH ═AlO2 + 2H2O
D. 电池工作时,Ni电极周围溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B,B能与纯碱反应。已知:
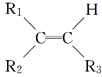
![]()
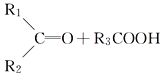
则符合上述条件的烃A有________种(不考虑顺反异构)( )
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是:
A.升高温度,可提高活化分子百分数,使有效碰撞几率提高,化学反应速率加快
B.碱性溶液均可以使无色酚酞试液变红色
C.pH=7的溶液中,Na+、Al3+、Cl-、NO3-可以大量共存
D.同类物质,键能越大,稳定性越弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的说法不正确的是 ( )
A. 化石能源物质内部贮存着大量的能量
B. 植物的光合作用使太阳能转化为化学能
C. 燃料燃烧时只是将化学能转化为热能
D.由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com