
| A.Cr2O72- | B.Cl2 | C.MnO4- | D.H2O2 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 物质 | 燃烧热(kJ?mol-1) |
| H2(g) | 285.8 |
| CO(g) | 283.0 |
| CH3CH2OH(l) | 1365.5 |
| 葡萄糖(s) | 2800 |
| 序号 | A | B | C | D | E |
| 污水类型 | 生活污水 | 印染 | 电镀 | 造纸 | 硫酸工业废水 |
| COD值(mg/L) | 520 | 870 | 20 | 960 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室通常用二氧化锰和浓盐酸反应制取Cl2。
(1)该反应的离子方程式为________________________________________________。
(2)甲、乙两同学用下列两种方法制取氯气:
甲:用含HCl
乙:用
则二者制得的Cl2(填序号)_______________。
①甲比乙多 ②乙比甲多 ③一样多 ④无法比较
Ⅱ.已知下列反应也可以生成氯气。
①2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2
2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
③2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
其中,适宜于实验室制取Cl2的反应是_____________(填序号,下同),适宜于工业上生产Cl2的反应是_____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省开封市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)
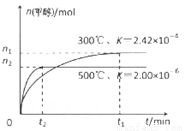
 CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
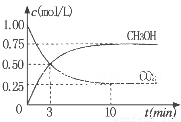
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为;CH3OH(g)
 CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。

查看答案和解析>>
科目:高中化学 来源:2014届江苏省泰州市姜堰区高三上学期期中考试化学试卷(解析版) 题型:实验题
镁在高温下与O2、N2或CO2均可以发生反应,试解决下列问题。
(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是 。
(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为 。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的反应步骤为
金属镁的作用为 ,在Ar气氛中的进行的理由是 。
(4)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知:
Mg+H2O MgO+H2↑ Mg3N2
+6H2O = 3Mg(OH)2+2NH3↑
MgO+H2↑ Mg3N2
+6H2O = 3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示。

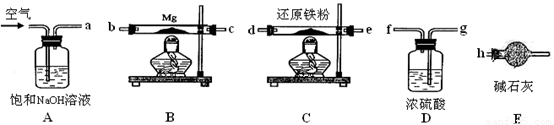
①导管口间的连接次序是:a →( )()→()()→()()→ h
②通气后,应先点燃 (填“B”或“C”)装置的酒精灯,装置A的作用是 ,装置E的作用是 。
③请设计一个简单的小实验验证产物是氮化镁 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com