


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解


| ||
| ||
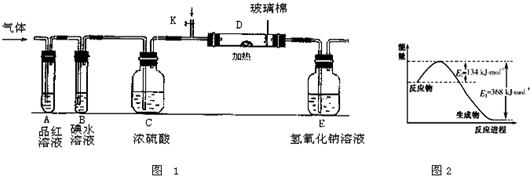
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子的还原性:Z<Y |
| B.水溶液的酸性:HY>HW |
| C.漂白作用:WX2>HWX |
| D.与水反应:Y2+H2O?HY+HYO |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省杭州市萧山中学高三(下)月考化学试卷(3月份)(解析版) 题型:填空题

查看答案和解析>>
科目:高中化学 来源:2011年北京市高考化学模拟试卷(四)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com