
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:吉林省长春二中2011-2012学年高一上学期期末考试化学试题 题型:058
氨气与灼热的氧化铜反应生成铜、氮气和水.利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去).回答下列问题.

(1)写出氨气与氧化铜反应的化学方程式.
(2)在A的锥形瓶中放入NaOH固体的目的是.
(3)在干燥管B里不能选用的干燥剂是(填序号).
A.碱石灰
B.生石灰
C.五氧化二磷
D.氢氧化钠
(4)在C的玻管中观察到的现象是________.
(5)E装置中盛装浓硫酸的目的是________.
(6)待实验完毕后,若实验测得N2的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为________mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为________.(用含a、b字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。
⑴写出氨气与氧化铜反应的化学方程式。
⑵在A的锥形瓶中放入NaOH固体的目的是。
⑶在干燥管B里不能选用的干燥剂是(填序号)。
A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠
⑷在C的玻管中观察到的现象是 。
⑸E装置中盛装浓硫酸的目的是 。
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为 。(用含a、b字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省长春二中高一上学期期末考试化学试卷 题型:实验题
(14分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。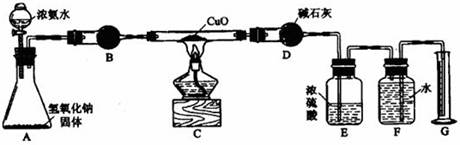
⑴写出氨气与氧化铜反应的化学方程式。
⑵在A的锥形瓶中放入NaOH固体的目的是。
⑶在干燥管B里不能选用的干燥剂是(填序号)。
A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠
⑷在C的玻管中观察到的现象是 。
⑸E装置中盛装浓硫酸的目的是 。
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为 。(用含a、b字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高一上学期期末考试化学试卷 题型:实验题
(14分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。

⑴写出氨气与氧化铜反应的化学方程式。
⑵在A的锥形瓶中放入NaOH固体的目的是。
⑶在干燥管B里不能选用的干燥剂是(填序号)。
A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠
⑷在C的玻管中观察到的现象是 。
⑸E装置中盛装浓硫酸的目的是 。
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为 。(用含a、b字母的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com