
| A.上述溶液中,将①和②等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO-3)+3c(CO2-3)+3c(H2CO3) |
| B.上述四种溶液中,由水电离的c(OH-)的大小关系为:①>②>③>④ |
| C.上述四种溶液中,分别加水稀释,所得溶液中c(H+)/c(OH-)的数值均增大 |
| D.上述四种溶液中,分别加入少量的NaOH固体,此时溶液的pH均增大 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三3月摸底考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.7.8克Na2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA
B.用铜做电极电解CuSO4溶液的反应方程式:
2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
C.常温时,浓度均为0.01mol/L的 Na2CO3溶液和NaHCO3溶液等体积混合,其溶液中粒子浓度关系为?? c(CO32-) +c(HCO3-)+c(H2CO3) =0.02mol/L
D.在蒸馏水中滴加浓H2SO4,KW不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省四校高三第四次联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.7.8克Na2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA
B.用铜做电极电解CuSO4溶液的反应方程式: 2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
C.常温时,浓度均为0.01mol/L的 Na2CO3溶液和NaHCO3溶液等体积混合,其溶液中粒子浓度关系为c(CO32-) +c(HCO3-)+c(H2CO3) =0.02mol/L
D.在蒸馏水中滴加浓H2SO4,KW不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省温州市十校联合体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-3mo1/L的AgNO3溶液和1×0-3mo1/LK2CrO4溶液混合,会有Ag2CrO4沉淀产生
B.Si—O键的键能大于Si—Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点
C.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为3c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)
D.已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1,下图可表示由CO生成CO2的反应过程和能量关系
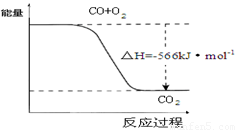
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com