
(4分)物质的量浓度相同的 ① 氨水 ② 氯化铵 ③ 碳酸氢铵 ④ 硫酸氢铵 ⑤ 硫酸铵五种溶液中c(NH4+)大小的顺序是__________________,溶液pH大小的顺序是__________________。
科目:高中化学 来源:2014-2015陕西岐山县高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
下列关于常见药物的用途不正确的是
A.阿司匹林具有治疗胃酸过多的作用
B.青霉素有阻止多种细菌生长的功能
C.麻黄碱具有止咳平喘作用
D.医疗上用少量鸦片作止泻、镇痛剂
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高一12月月考化学试卷(解析版) 题型:选择题
(8分)写出下列反应的方程式或离子方程式
(1)有人混用洗涤剂发生中毒的事件,当事人先用洁厕灵(强酸性,含盐酸),再用84消毒液(碱性,含NaClO)进行杀菌,请写出涉及反应的离子方程式 。
(2)在FeCl2溶液中滴入氨水并放置一段时间,发生的化学反应方程式(若属于离子反应的则写离子方程式) 。
(3)FeCl2能否通过化合反应来制取,若不能,写出不能制备的理由;若能,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高一12月月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是
A.1.01×105Pa,20℃时48g O3含有的分子数为NA
B.1molNa2O2晶体中阴离子数为2 NA
C.标准状况下,33.6L的 乙醇(C2H5OH)中含有的碳原子数目为3NA
D.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高一12月月考化学试卷(解析版) 题型:选择题
已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是
A. R B.
R B.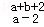 R C.
R C. R D.
R D. R
R
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高二12月月考化学试卷(解析版) 题型:实验题
(10分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.02 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.98 | 20.00 |
(1)滴定达到终点的现象 ;此时锥形瓶内溶液的pH的范围是 。
(2)根据上述数据,可计算出该盐酸的浓度为 。
(3)排去碱式滴定管中气泡的方法应采用下图的操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有 (多选扣分):
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高二12月月考化学试卷(解析版) 题型:选择题
根据下列有关图象,说法正确的是

A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C.由图Ⅱ知,t3时采取降低反应温度的措施
D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高二12月月考化学试卷(解析版) 题型:选择题
在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g)  C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是
A.混合气体的压强
B.混合气体的密度
C.气体的总物质的量
D.单位时间内生成n mol C的同时消耗2n molB
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省淮南市高一上学期期末考试化学试卷(解析版) 题型:填空题
按要求回答下列问题:
(1)O4是意大利的一位科学家合成的一种新型氧分子,一个分子由四个氧原子构成,在相同条件下,等质量的O4和O3氧原子数之比为 ;两种气体的体积之比为 。
(2)已知下列几种物质①氨气②液氯③硫酸④盐酸⑤酒精⑥烧碱⑦氢氧化铁胶体,其中属于电解质的
是 (填写序号)。
(3)硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下:

物质A的化学式为 ;制备粗硅的反应为置换反应,且生成的气体具有还原性,该反应的化学方程式为 (提示:石英砂的主要成分是SiO2) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com