
����Ŀ����֪AΪ���ʣ�B��C��D��EΪ���������֮���������ת����ϵ��
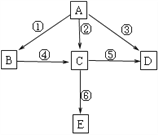
��1����AΪ�ǽ������ʣ�BΪþ���ڿ�����ȼ�յIJ���֮һ������ˮ��Ӧ����������C��DΪ��ɫ���壬�ڿ����пɱ�ɺ���ɫ��C��HCl���巴Ӧ����Eʱ�����������̣���B�ĵ���ʽΪ___________��B�����ᷴӦ�Ļ�ѧ����ʽΪ___________________��������Ӧ������������ԭ��Ӧ����________��
��2����AΪ�����г����Ľ������ʣ�BΪA�����ᷴӦ�IJ��C��ͨ�����ʼ�Ļ��Ϸ�Ӧ�Ƶã��������ɲ�����C����Һ�ɵõ�����ɫ��D����C�����ˮ�пɵ�E�Ľ��壬����Bת��ΪC�����ӷ���ʽΪ________________���������ɲ�����C����Һ�ɵ�D��ԭ����________________��
���𰸡� ![]() Mg3N2 + 8HCl �� 3 MgCl2 +2NH4Cl �٢ڢۢ� 2Fe2+ +Cl2 = 2Fe3+ +2Cl- FeCl3ˮ����������ˮ�����HCl�ӷ����Ӷ�����ˮ������Fe(OH)3������ʱ�ֽ�����Fe2O3
Mg3N2 + 8HCl �� 3 MgCl2 +2NH4Cl �٢ڢۢ� 2Fe2+ +Cl2 = 2Fe3+ +2Cl- FeCl3ˮ����������ˮ�����HCl�ӷ����Ӷ�����ˮ������Fe(OH)3������ʱ�ֽ�����Fe2O3
�������������������1����AΪ�ǽ������ʣ�BΪþ���ڿ�����ȼ�յIJ���֮һ������ˮ��Ӧ����������C�� DΪ��ɫ���壬�ڿ����пɱ�ɺ���ɫ��C��HCl���巴Ӧ����Eʱ�����������̣���AΪ������BΪ����þ��CΪ������DΪNO��EΪ�Ȼ������B�ĵ���ʽΪ![]() ��B�����ᷴӦ�Ļ�ѧ����ʽΪMg3N2 + 8HCl �� 3 MgCl2 +2NH4Cl��������Ӧ���л��ϼ۱仯���Ǣ٢ڢۢ�������������ԭ��Ӧ���Т٢ڢۢ���
��B�����ᷴӦ�Ļ�ѧ����ʽΪMg3N2 + 8HCl �� 3 MgCl2 +2NH4Cl��������Ӧ���л��ϼ۱仯���Ǣ٢ڢۢ�������������ԭ��Ӧ���Т٢ڢۢ���
��2����AΪ�����г����Ľ������ʣ�BΪA�����ᷴӦ�IJ��C��ͨ�����ʼ�Ļ��Ϸ�Ӧ�Ƶã��������ɲ�����C����Һ�ɵõ�����ɫ��D����C�����ˮ�пɵ�E�Ľ��壬��AΪ����BΪ�Ȼ�������CΪ�Ȼ�����DΪ��������EΪ��������������������Bת��ΪC�����ӷ���ʽΪ2Fe2+ +Cl2 = 2Fe3+ +2Cl-���������ɲ�����C����Һ�ɵ�D��ԭ����FeCl3ˮ�����ȣ���ˮ�����HCl�ӷ����Ӷ�����ˮ������Fe(OH)3������ʱ�ֽ�����Fe2O3 ��


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ԭ��ǿ����I����Fe2������100 mL�⻯������Һ�л���ͨ��3.36 L(��״��)��������Ӧ��ɺ���Һ����һ���Fe2+��������Fe3+����ԭ�⻯������Һ�����ʵ���Ũ��Ϊ
A. 1.2 mol��L��1 B. 1.5 mol��L��1 C. 1.0 mol��L��1 D. 1.1 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Fe��FeO��Fe2O3�Ļ�����У�����100mL 1mol/L�����ᣬǡ��ʹ�������ȫ�ܽ⣬�ų�224mL����״���£������壬������Һ�м���KSCN��Һ��Ѫ��ɫ���֣���ԭ���������Ԫ�ص�����Ϊ�� ��
A.5.6g
B.2.8g
C.11.2g
D.1.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ҵ���˵����ȷ����
A. �����ụΪͬ���칹�� B. ������ȼ��
C. ���ܷ���������Ӧ D. ���ڸ߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ֱ��Ŀ���״��ͬ������Ϊ7g ������ͬʱ��������������Һ�У�����H2���������ǣ� ��
A.150mL 2mol��L-1������B.500mL 2mol��L-1������
C.50mL 6mol��L-1��ϡ����D.50mL 18.4mol��L-1������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ��2L���ܱ������У�����4mo1A��2molB�������·�Ӧ��
3A(g)+2B(g)![]() 4C(��)+2D(��)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6molC,�ҷ�Ӧ��ǰ���ѹǿ֮��Ϊ5:4 ����ͬ���¶��²�����, ������˵����ȷ����
4C(��)+2D(��)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6molC,�ҷ�Ӧ��ǰ���ѹǿ֮��Ϊ5:4 ����ͬ���¶��²�����, ������˵����ȷ����
A. �÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��![]()
B. ��ʱ��B ��ƽ��ת������35%
C. �������ϵ��ѹǿ��ƽ�������ƶ���ѧƽ�ⳣ������
D. ����C������B��ƽ��ת���ʲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����пƬ��ͭƬ��ϡ������ɵ�ԭ��أ�����˵��������ǣ� ��
A.пΪ������ͭΪ����B.ͭƬ��������ð��
C.пƬ�Ϸ�����ԭ��ӦD.����������ͭƬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����l����������ʵ�У�ʲô����Ӱ���˻�ѧ��Ӧ�����ʣ�
�����ڵ�KClO3�ų����ݺ�������������MnO2�ܿ��������______��
��ͬŨ�ȡ�ͬ����������з���ͬ����С��п����þ�������������п�����______��
��KI�����HgCl2�����Ϻ�������������һ��Ͷ��ˮ�У��ܿ����ɺ�ɫHgI2______��
��2��ij̽��С���ò���HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء���ѡ�Լ���1.00 mol/LHNO3��2.00 mol/LHNO3��ϸ��������ʯ���ֿ�������ʯ��35��ˮԡ��
��������ܽ��е�̽�����ݣ���д����ʵ����Ʊ������̽��ʵ�飺
ʵ���� | T�� | ����ʯ��� | HNO3Ũ�ȣ�mol/L�� |
A | ���� | 2.00 | |
B | �ֿ��� | 1.00 | |
C | �ֿ��� | 2.00 | |
D | ϸ���� | 2.00 |
������ʵ����Ӧ���ƵIJ�������������Һ�����______��
�۸�ʵ��С��������ͼʵ��װ�ý���ʵ�顣

a����������ƽ������ܡ���ƿ��ҩ�ס������������⣬�����ʵ����������______��
b������Ӧ��ʼʱ������ƽ����Ϊ100.00g����2���ӷ�Ӧ����ʱ�Ķ���Ϊ95.60g����������������CaCO3����ʾ������Ϊ_____g/min��
c�������������װ�ã���������______������ƫ��������ƫС����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��ԭ����У�����˵����ȷ���ǣ� �� 
A.Zn������Cu����
B.������ӦΪ Zn��2e���TZn2+
C.������ӦΪCu��2e���TCu2+
D.��װ���ܽ�����ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com