
根据热化学方程式:S(g)+O2(g) SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
A.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量
B.1个S(g)与1个O2(g)完全反应要放出Q kJ的热量
C.S(s)+O2(g) SO2(g) △H<-Q kJ·mol-1
SO2(g) △H<-Q kJ·mol-1
D.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,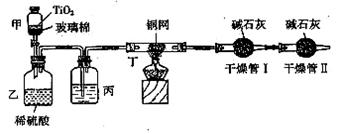 先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
CN-被处理的百分率。
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.2 mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。
丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅱ的作用是 。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比
__________(填“偏高”或“偏低”),简述可能的原因: 。
(4)若干燥管Ⅰ中碱石灰增重1.408 g,则该实验中测得CN-被处理的百分率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A. 常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体
B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性
C.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,
待合金完全溶解后,收集到6.72L(标准状况)NO和NO2的混合气体,并测得溶液中H+浓度为1mol/L。
假设反应后溶液的体积仍为80mL,试计算.
(1)被还原硝酸的物质的量。
(2)合金中银的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中每种物质都既有离子键又有共价键的一组是
A.NaOH、H2SO4 、(NH4) 2SO4 B.MgO、Na2SO4、HNO3
C.Na2O2、KOH、Na3PO4 D.HCl、Fe2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏伽德罗常数的述职,下列说法中正确的是( )
A、在标准状况下,33.6LSO3中含有的氧原子数是4.5NA
B、两份均为2.7g的铝样品分别为100mL浓度均为2mol·L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3 NA
C、常温常压下, 和
和 的混合气体中所含共用电子对数目为3a/14·NA
的混合气体中所含共用电子对数目为3a/14·NA
D、6.0g金刚石中含有的共价键数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是
A.除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离
B.除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏
C.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com