
(15分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI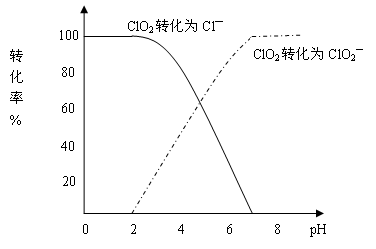
①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是 (填化学式)。
①ClO2-+4I-+4H+=Cl-+2H2O+2I2。
②调节溶液的pH不大于2.0。
③锥形瓶溶液由蓝色变为无色,且半分钟不复原
④C(V2-4V1)/4V
⑤Fe(OH )3
解析试题分析:(1)根据图像可知,pH≤2.0时,CIO2—也能被I- 完全还原成Cl—,那么I-要被氧化为碘单质,溶液是酸性溶液,则可正确写出离子方程式即反应的离子方程式是ClO2-+4I-+4H+=Cl-+2H2O+2I2。
完全还原成Cl—,那么I-要被氧化为碘单质,溶液是酸性溶液,则可正确写出离子方程式即反应的离子方程式是ClO2-+4I-+4H+=Cl-+2H2O+2I2。
(2)根据曲线图示在pH≤2.0时, ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量。
(3)由于碘遇淀粉显蓝色,所以终点时的现象判断依据为锥形瓶溶液由蓝色变为无色,且半分钟不复原。
(4)由2ClO2+2I-=2ClO2-+I2和Na2S2O3+I2=Na2S4O6+2NaI可知
2ClO2- ~ Na2S2O3
则n(ClO2-) c×V1/1000 n(ClO2-)=2 c×V1/1000
由ClO2-+4H++4I-=Cl-+2I2+2H2O 和Na2S2O3+I2=Na2S4O6+2NaI可得
ClO2-~ 2 Na2S2O3
n(ClO2-)总 c×V2/1000
n(ClO2-)总=1/2 c×V2/1000
所以原水样中ClO2-浓度=[ 1/2 c×V2/1000-2 c×V1/1000]/V/1000
=c(V2-4V1)/4V
(5)根据反应4Fe2++ClO2-+2H2O 4Fe3++Cl-+4OH-,Fe3++ OH-
4Fe3++Cl-+4OH-,Fe3++ OH- Fe(OH)3可知,氧化产物为Fe(OH)3。
Fe(OH)3可知,氧化产物为Fe(OH)3。
考点:考查图像识别、离子方程式的书写、终点现象的判断、化学计算以及氧化产物的判断
点评:该题是高考中的常见图像,难度较大,学生不易得分。该题既有定性的分析,也有定量的计算,另外还要结合图表和图像,增加了试题的难度。该类试题要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.| 50a |
| 13 |
| 50a |
| 13 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
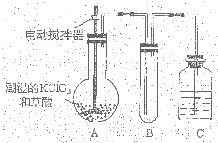 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
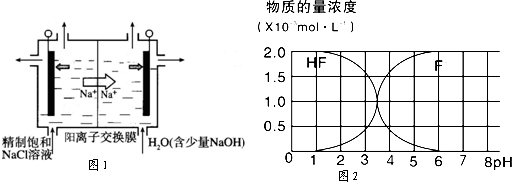
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com