
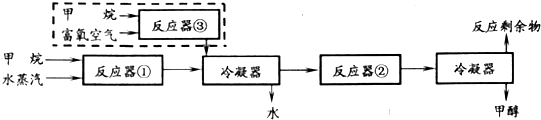
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氧气的物质的量;混合气体与氧气、水反应又得到硝酸,根据电子转移守恒,Cu原子失去的电子等于氧气获得的电子,所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀生成Cu(OH)2,由电荷守恒,OH-的物质的量等于氧气获得电子物质的量,进而计算NaOH溶液的体积;
(2)反应中CH4转化率为100%,根据反应①计算生成的CO、H2的体积,反应②中CO有$\frac{2}{3}$转化,计算参加反应的CO、H2的体积,再根据反应②计算参加反应的H2的体积,进而计算剩余CO、H2的体积,根据n=$\frac{V}{{V}_{m}}$计算它们的物质的量;
(3)假设充入反应器③的甲烷的体积为V,根据反应①、③表示出生成的CO、H2的体积,反应②中CO有$\frac{2}{3}$转化,计算参加反应的CO、H2的体积,进而计算剩余CO、H2的体积,再结合反应剩余物中V(H2):V(CO)=3:1进行计算.
解答 解:(1)1.68L氧气的物质的量$\frac{1.68L}{22.4L/mol}$=0.075mol;
混合气体与氧气、水反应又得到硝酸,根据电子转移守恒,Cu原子失去的电子等于氧气获得的电子,所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀生成Cu(OH)2,由电荷守恒,OH-的物质的量等于氧气获得电子物质的量,故n(OH-)=0.075mol×4=0.3mol,则V(NaOH)=$\frac{0.3mol}{5mol/L}$=0.06L=60mL,
故答案为:0.075mol;60mL;
(2)反应中CH4转化率为100%,甲烷和水蒸汽的体积分别为672m3和1750m3,由CH4(g)+H2O→CO(g)+3H2(g),可知水蒸气有剩余,则:
CH4(g)+H2O→CO(g)+3H2(g)
672m3 672m3 2016m3
反应②中CO有$\frac{2}{3}$转化,故参加反应的CO为672m3×$\frac{2}{3}$=448m3,由CO(g)+2H2(g)→CH3OH(g),可知参加H2的体积为449m3×2=896m3,故剩余CO为672m3-448m3=224m3,其物质的量为$\frac{224×1000L}{22.4L/mol}$=10000mol,剩余H2的体积为2016m3-896m3=1124m3,其物质的量为$\frac{1124×1000L}{22.4L/mol}$=50000mol,
故答案为:10000mol;50000mol;
(3)反应器①的甲烷和水蒸汽的体积分别为am3和3am3,假设充入反应器③的甲烷的体积为V,则:
CH4(g)+H2O→CO(g)+3H2(g) 2CH4(g)+O2(g)→2CO(g)+4H2(g)
a a 3a V V 2V
反应②中CO有$\frac{2}{3}$转化,参加反应的CO为$\frac{2}{3}$(a+V)m3,由CO(g)+2H2(g)→CH3OH(g),可知参加H2的体积为$\frac{2}{3}$(a+V)m3×2=$\frac{4}{3}$(a+V)m3,故剩余CO为$\frac{1}{3}$(a+V)m3,剩余H2的体积为(3a+2V)m3-$\frac{4}{3}$(a+V)m3=$\frac{1}{3}$(5a+2V)m3,
故$\frac{1}{3}$(5a+2V)m3:$\frac{1}{3}$(a+V)m3=3:1,解得V=2am3,
答:充入反应器③的甲烷的体积为2am3.
点评 本题考查混合物的有关计算、化学反应方程式有关计算,侧重考查学生分析计算能力,难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列关于烷烃性质的叙述中,不正确的是( )
A.烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高
B.烷烃都能使溴水、酸性KMnO4溶液褪色
C.烷烃跟卤素单质在光照条件下能发生取代反应
D.烷烃同系物的密度随着相对分子质量的增大逐渐增大
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:推断题
有机化学推断题:
DEET又名避蚊胺,化学名为N,N-二乙基间甲苯甲酰胺,其结构简式为: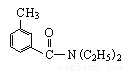 ;DEET在一定条件下,可通过下面的路线来合成:
;DEET在一定条件下,可通过下面的路线来合成:

已知:RCOOHRCOCl(酰氯,化学性质十分活泼);
RCOCl+NH3→RCONH2+HCl
根据以上信息回答下列问题:
(1)由DEET的结构简式推测,下列叙述正确的是 。(填字母)
A.它能使酸性高锰酸钾溶液褪色
B.它能发生酯化反应
C.它与甲苯互为同系物
D.一定条件下,它可与H2发生加成反应
(2)B的结构简式为 。
(3)在反应④~⑦中,属于取代反应的有 (填序号)。
(4)写出C→DEET的化学反应方程式 。
(5)E的同分异构体中能与FeCl3溶液发生显色反应,且不含乙基的有机物共有 种。
(6)经核磁共振氢谱图显示,A的某种同分异构体J只有两个吸收峰,试写出J的化学名称 ;J物质被酸性高锰酸钾氧化后得到的产物在一定条件下可与乙二醇反应,制成当前合成纤维的第一大品种涤纶(聚酯纤维),试写出生产涤纶的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关工业合成氨的说法不能用平衡移动原理解释的是
A.不断补充氮气和氢气
B.选择20MPa-50MPa的高压
C.及时液化分离氨气
D.选择500℃左右同时使用铁触媒做催化剂
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:推断题
有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与足量的NaOH溶液反应后的产物,其一氯代物只有一种。
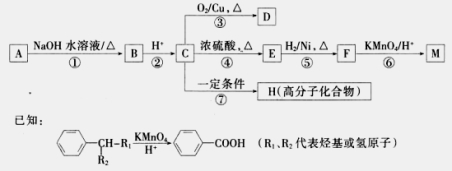
请回答:
(1)B、F的结构简式分别为____________、。
(2)反应①~⑦中,属于氧化反应的是________(填反应序号)。
(3)写出反应④的化学方程式__________________。
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为_______________________。
(5)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,下列确定该官能团的哪些实验方法是正确的________。
A.取少量A于试管中,再加入苯振荡,观察分液后上层溶液颜色
B.取少量A于试管中,再加入NaOH溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
C.取少量A于试管中,再滴入AgNO3溶液,再加入稀硝酸.观察沉淀颜色
D.取少量A于试管中,再加入NaOH的醇溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
(6)符合下列条件的F的同分异构体共有______种。
A.能发生银镜反应
B.能与FeCl3溶液发生显色反应
C.核磁共振氢谱上有四个峰,其蜂面积之比为l:1:2:6
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲是亚硫酸氢钠粉末投入稀硝酸溶液中的有关图象 | |
| B. | 乙是等pH的MCl2和NCl2溶液稀释时pH变化图象,由此可推测M的金属性较强 | |
| C. | 由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)═2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ•mol-1 | |
| D. | 丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
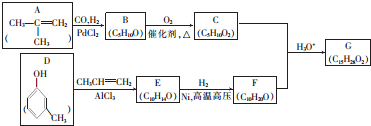
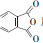 反应可生成1mol百里酚酞
反应可生成1mol百里酚酞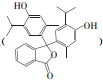
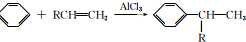
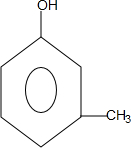 +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$ ;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.
;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.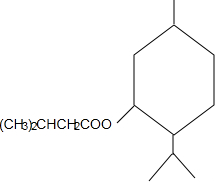 .
.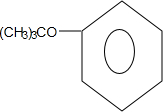 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| A | CO2 | SO2 | 澄清石灰水 |
| B | HCl | CO2 | Ba(OH)2 |
| C | CO2 | SO2 | Ba(NO3)2 |
| D | CO2 | NH3 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com