解:(1)高锰酸钾溶液为紫红色,当达到滴定终点时,再滴入高锰酸钾溶液时,溶液变成紫红色且半分钟内不褪色,
故答案为:不需要;溶液变成紫红色且半分钟内不褪色;
(2)KMnO
4溶液中KMnO
4的物质的量为n=C×V=0.02000mol?L
-1×0.03L=6×10
-4 mol,根据硫元素守恒:
5Fe
2++MnO
-4 +8H
+=5Fe
3++Mn
2++4H
2O; SO
2 +2Fe
3++2H
2O=SO
42-+2Fe
2++4H
+; FeS
2 ~2SO
2 5 1 1 2 1 2
3×10
-3mol 6×10
-4 mol 1.5×10
-3mol 3×10
-3mol 7.5×10
-4mol 1.5×10
-3mol
样品中FeS
2的质量分数
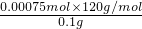
×100%=90%,
故答案为:90%;
(3)6g纯净FeS
2的物质的量为n=

=
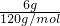
=0.05mol,含有硫的物质的量为:0.1mol,全部被氧化为SO
3气体,再将产生的SO
3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,则1molSO
3气体全部与水化合生成硫酸溶液时,放出130.3kJ热量,所以热化学方程式为:SO
3(g)+H
2O(l)═H
2SO
4(aq)△H=-130.3KJ/mol;
故答案为:SO
3(g)+H
2O(l)═H
2SO
4(aq)△H=-130.3KJ/mol;
(4)①用CH
4催化还原NO
x为N
2可以消除氮氧化物的污染,反应物为CH
4和NO
x,生成物为N
2,根据化学反应质量守恒,产物须有水和二氧化碳,然后配平得xCH
4+4NO
x═2N
2+xCO
2+2H
2O,
故答案为:xCH
4+4NO
x═2N
2+xCO
2+2H
2O;
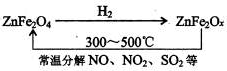
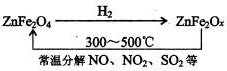
②新型纳米材料ZnFe
2O
X可由化合物ZnFe
2O
4经高温还原制得,若2mol ZnFe
2O
X与SO
2反应可生成0.75molS,则ZnFe
2O
X被还原为ZnFe
2O
4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.75mol×4,解得,a=2.25,利用化合价代数和为零,2+2.25×2=2x,解得x=3.25
故答案为:3.25.
分析:(1)高锰酸钾为紫红色,过程中不需要加指示剂;
(2)根据二氧化硫和硫酸铁反应,根据二价铁和高锰酸钾反应的方程式进行解答;
(3)三氧化硫和水反应生成硫酸,根据热化学方程式的意义,方程式中物质前的系数表示物质的量,据此解答;
(4)①根据反应物和生成物结合氧化还原反应原理解答;②根据得失电子守恒和化学式中元素化合价代数和为零解答.
点评:本题比较综合,考查了氧化还原、热化学方程式的书写等知识,解答时须熟练掌握氧化还原反应的原理,题目较难.


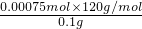 ×100%=90%,
×100%=90%, =
=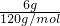 =0.05mol,含有硫的物质的量为:0.1mol,全部被氧化为SO3气体,再将产生的SO3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,则1molSO3气体全部与水化合生成硫酸溶液时,放出130.3kJ热量,所以热化学方程式为:SO3(g)+H2O(l)═H2SO4(aq)△H=-130.3KJ/mol;
=0.05mol,含有硫的物质的量为:0.1mol,全部被氧化为SO3气体,再将产生的SO3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,则1molSO3气体全部与水化合生成硫酸溶液时,放出130.3kJ热量,所以热化学方程式为:SO3(g)+H2O(l)═H2SO4(aq)△H=-130.3KJ/mol;