
下列分子或离子在指定的分散系中能大量共存的一组是( )
A.银氨溶液:Na+、K+、N 、NH3·H2O
、NH3·H2O
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、S 、葡萄糖分子
、葡萄糖分子
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:填空题
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是( )。
选项实验现象解释或结论
Aa处变蓝,b处变
红棕色氧化性:Cl2>Br2>I2
Bc处先变红,后褪色氯气与水生成了酸性物质
Cd处立即褪色氯气与水生成了漂白性物质
De处变红色还原性:Fe2+>Cl-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:选择题
在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子 (NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1B.2.5 mol·L-1C.5 mol·L-1D.7.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:填空题
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 性,请写出工业上用氯气与NaOH溶液反应生产消毒剂NaClO的离子方程式 。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O和NaHCO3的离子方程式 。
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为 。
②ClO2遇浓盐酸会生成Cl2,每生成1 mol Cl2转移电子的物质的量为 。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4 mol HCl被氧化放出115.6 kJ的热量。

则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:填空题
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:

(1)在人体血液中,HC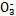 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,HC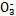 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(HC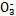 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1、c(C )=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:选择题
在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中正确的是( )
H++Cl-+HClO。下列说法中正确的是( )
A.光照一段时间后,c(HClO)减小
B.加入碳酸钙粉末后,溶液的pH增大,可以提高HClO浓度
C.加入少量水,由水电离的c(H+)减小
D.加入少量NaOH固体, 增大
增大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:选择题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有 。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com