
| A. | 构成原电池正极和负极的材料必须是金属 | |
| B. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| C. | 实验室欲快速制取氢气,可利用粗锌与稀H2SO4反应 | |
| D. | 原电池可以把物质内部的能量全部转化为电能 |
分析 A、燃料电池中电极可以是石墨;
B、原电池中负极失电子被氧化;
C、形成原电池能加快反应速率;
D、原电池中化学能除转化为电能外,还有部分转化为热能.
解答 解:A、燃料电池中电极可以是石墨,原电池的正极材料也可以选用石墨电极,故A错误;
B、原电池中负极失电子被氧化,正极得电子被还原,故B错误;
C、粗锌与稀硫酸能形成原电池,能加快反应速率,所以实验室欲快速制取氢气,可利用粗锌与稀硫酸反应,故C正确;
D、原电池中化学能除转化为电能外,还有部分转化为热能,原电池的能量转化率小于100%,故D错误.
故选C.
点评 本题考查了原电池知识,题目难度不大,侧重于基础知识的考查,注意把握原电池中电极的判断.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
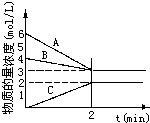 选择适宜的材料和试剂设计一个原电池,完成下列反应:
选择适宜的材料和试剂设计一个原电池,完成下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能与FeCl3溶液反应生成紫色沉淀 | |
| B. | 苯酚呈弱酸性,能使紫色石蕊试液显浅红色 | |
| C. | 向少量苯酚溶液中滴加饱和溴水,可观察到白色沉淀 | |
| D. | 苯酚有强腐蚀性,沾在皮肤上可用水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
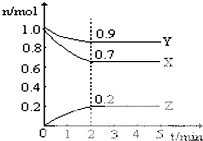 某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
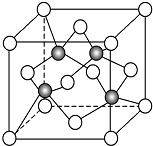 碳及其化合物与人类关系密切
碳及其化合物与人类关系密切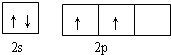 ,C、N、O三元素的第一电离能由大到小的顺序为N>O>C,在丙烯分子中碳原子的杂化方式为sp2、sp3.
,C、N、O三元素的第一电离能由大到小的顺序为N>O>C,在丙烯分子中碳原子的杂化方式为sp2、sp3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com