
(9分)用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。 请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)右图是某次滴定时的滴定管中的液面,其读数为 mL
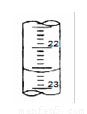
(5)下表中数据为某同学在三次滴定实验中所得,据你分析,三组数据是否都合理,如果不是,其中应舍弃的是第 次。(填写序号)
|
滴定次数 |
待测体积(ml) |
标准烧碱体积(ml) |
|
|
滴定前读数 |
滴定后读数 |
||
|
第1次 |
20.00 |
0.40 |
20.40 |
|
第2次 |
20.00 |
4.00 |
24.00 |
|
第3次 |
20.00 |
0.10 |
22.10 |
(1)①;偏大 (2)偏小 (3)无 ;浅红 (4)22.60 (5)3
【解析】
试题分析:(1)错误的步骤是①,滴定管洗涤完之后要润洗,否则会使溶液的浓度偏小,因此使用溶液的体积比正常值大,测定结果会偏高。
(2)在记下滴定管液面读数时,滴定管尖嘴有气泡,则使用液体的体积比正常值小,所以测定结果偏小。
(3)碱滴酸中用酚酞做指示剂,滴定终点为锥形瓶中溶液从无色变为浅红色,且半分钟不变色。
(4)从图中可知滴定管的读数为22.60mL。
(5)从数据上可知,第三次的数据偏差较大。
考点:酸碱中和滴定
点评:本题非常基础简单,主要考查了误差分析和滴定中的基础知识。


科目:高中化学 来源: 题型:
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并直接注入NaOH溶液至“0”刻度线以上
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并直接注入NaOH溶液至“0”刻度线以上| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液 体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.45 |
| 第二次 | 10.00 | 4.00 | 24.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.00l0 | 0.0100 | 0.0200 | 0.1000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com