
| A. | Na2O2固体溶于足量水中:2O${\;}_{2}^{2-}$+2H2O═4OH-+O2↑ | |
| B. | 次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液中滴入少量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 硝酸铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
分析 A.氧化物应保留化学式;
B.二氧化碳过量反应生成碳酸氢钙;
C.氢氧化钠少量反应生成碳酸钙、碳酸氢钠和水;
D.不符合反应客观事实.
解答 解:A.Na2O2固体溶于足量水中,离子方程式:2Na2O2+2H2O═4OH-+O2↑+4Na+,故A错误;
B.次氯酸钙溶液中通入过量的CO2,离子方程式:ClO-+H2O+CO2═HCO3-+HClO,故B错误;
C.碳酸氢钙溶液中滴入少量的NaOH溶液,离子方程式:Ca2++HCO3-+OH-═CaCO3↓+H2O,故C正确;
D.氢氧化铝不溶于氨水,二者反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,题中离子方程式正确,评价不合理,故D错误;
故选:C.
点评 本题考查了离子方程式书写,明确反应实质是解题关键,注意离子方程式书写应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe | |
| C. | NaOH(aq)$\stackrel{CuSO_{4}(aq)}{→}$Cu(OH)2$→_{△}^{葡萄糖}$Cu2O | |
| D. | NH3$→_{催化剂}^{O_{2},△}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3已部分氧化 | |
| B. | 加入硝酸钡溶液生成的沉淀一定含BaSO4 | |
| C. | 加入硝酸后的沉淀一定含BaSO3 | |
| D. | 此实验不能确定Na2SO3是否部分氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

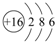 .
. .
.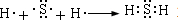 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (R、R′、R〞表示氢、烷基或芳基)合成五元环有机化合物J 的路线如下:
(R、R′、R〞表示氢、烷基或芳基)合成五元环有机化合物J 的路线如下:
 ,它的分子子中有3种不同类型的官能团,它是J的同分异构体;
,它的分子子中有3种不同类型的官能团,它是J的同分异构体; ;
; +H2O;E的核磁共振氢谱中应该具有6组峰.
+H2O;E的核磁共振氢谱中应该具有6组峰. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60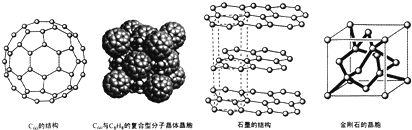
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2C1O-+H2O+SO2═CaSO3↓+2HC1O | |
| C. | 氢氧化钙溶液气碳酸氢镁溶液反应:Ca2++OH-+HCO3 -═CaCO3↓+H2O | |
| D. | 硫酸亚铁的酸性溶液中加入H2O2溶液:Fe 2++H2O2+2H+═Fe 3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com