
| 化学键 | H-O | O=O | N≡N | N-H |
| 键能KJ•mol-1 | 463 | 496 | 942 | 391 |
分析 (1)反应的焓变△H=反应物总键能-生成物总键能;
(2)A.催化剂改变反应途径,降低反应活化能;
B.不同物质表示的正、逆反应速率之比等于化学计量数之比时,反应达到平衡状态;
C.当反应达到平衡状态时,正、逆反应速率相等,各物质的浓度、百分含量不变;
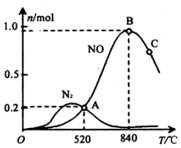
(3)①根据生成物氮气、NO的物质的量判断催化剂对反应的选择性;
②520℃平衡时n(NO)=n(N2)=0.2mol,利用方程式计算两个反应消耗的氨气、氧气物质的量以及生成的水的物质的量,可以计算平衡时氨气与氧气物质的量,由于容器体积为1L,利用物质的量代替浓度带入K=$\frac{{c}^{4}(NO)•{c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3})•{c}^{5}({O}_{2})}$计算;
③催化剂不影响平衡移动,改变浓度与投料比不影响催化剂对反应的选择性,图中温度影响催化剂选择性;
(4)①计算铵根离子与亚硫酸根的水解平衡常数进行判断;
②根据亚硫酸铵溶液酸碱性选择;根据电荷守恒计算判断$\frac{c{(NH}_{4}^{+})}{c(S{{O}_{3}}^{2-})}$ 比值问题.
解答 解:(1)反应的焓变△H=反应物总键能-生成物总键能=4×3×391KJ/mol+3×496KJ/mol-2×942KJ/mol-6×2×463KJ/mol=-1260KJ/mol,
故答案为:-1260KJ/mol;
(2)A.加入催化剂,改变反应途径,降低反应的活化能,增加了活化分子百分数,化学反应速率增大,故A正确;
B.对于反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),应是 6v 正(NH3)=4v 逆(H2O)时,反应达到平衡状态,故B错误;
C.当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,与 $\frac{n(NO)}{n(N{H}_{3})}$=1 无关,故C错误.
故选:A;
(3)①由图可知,该催化剂在高温时,生成的NO物质的量远大于氮气的,故该催化剂在高温下选择反应I,
故答案为:I;
②在 1L 密闭容器中充入 1mol NH3和 2mol O2,520℃平衡时n(NO)=n(N2)=0.2mol,则:
4NH3(g)+5O2?4NO(g)+6H2O(g)
变化(mol ):0.2 0.25 0.2 0.3
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)
变化(mol ):0.4 0.3 0.2 0.6
故平衡时,n(NH3)=1mol-0.2mol-0.4mol=0.4mol,n(O2)=2mol-0.25mol-0.3mol=1.45mol,n(H2O)=0.3mol+0.6mol=0.9mol,由于容器体积为1L,利用物质的量代替浓度计算平衡常数K=$\frac{{c}^{4}(NO)•{c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3})•{c}^{5}({O}_{2})}$=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$,
故答案为:$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$;
③A.使用催化剂不影响平衡移动,加快反应速率,缩短到达平衡的时间,故错误;
B.使用催化剂不影响平衡移动,加快反应速率,缩短到达平衡的时间,故错误;
C.增大 NH3和 O2 的初始投料比,平衡常数不变,不影响催化剂对反应的选择性,故错误;
D.投料比不变,增加反应物的浓度,平衡常数不变,不影响催化剂对反应的选择性,故错误;
E.由图可知低温有利于氮气的生成,降低反应温度有利于提高 NH3 转化为 N2 平衡转化率,故正确.
故选:E;
(4)①Kh(NH4+)=$\frac{Kw}{Kb}$=$\frac{1{0}^{-14}}{1.8×1{0}^{-5}}$≈5.6×10-10,Kh(SO32-)=$\frac{Kw}{{K}_{a2}}$=$\frac{1{0}^{-14}}{6.3×1{0}^{-8}}$≈1.6×10-7,铵根离子水解由于Kh(NH4+)<Kh(SO32-),故亚硫酸铵溶液呈碱性,
故答案为:碱;
②亚硫酸铵溶液呈碱性,需要通入酸性气体可使溶液呈中性,即上述溶液中通入SO2气体可使溶液呈中性,
由电荷守恒有:c(H+)+c(NH4+)=2c(SO32-)+c(HSO3-)+c(OH-),中性条件下c(H+)=c(OH-),联立可得:c(NH4+)=2c(SO32-)+c(HSO3-),则$\frac{c{(NH}_{4}^{+})}{c(S{{O}_{3}}^{2-})}$>2,
故答案为:>.
点评 本题考查反应热计算、化学平衡状态及其影响因素、对图象的分析问题、化学平衡常数计算、电离平衡常数应用、离子浓度比较等,属于拼合型题目,是高考热点题型,平衡常数计算为易错点,关键是平衡体系中氨气与氧气浓度有关计算.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H14O的醚有15种 | |
| B. | 将气体通过酸性高锰酸钾溶液可提纯含有乙烯杂质的乙烷 | |
| C. | 分馏、干馏都属于物理变化,裂化、裂解都属于化学变化 | |
| D. | 聚乙烯、橡胶、聚酯纤维都是通过加聚反应制得的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b+2a+2 X | B. | a+b-2a-2 X | C. | b-2a+2 X | D. | ba X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属单质M能从N的化合物中置换出非金属单质N | |
| B. | 在反应中M原子比N原子得到更多电子 | |
| C. | M的气态氢化物稳定性比N弱 | |
| D. | M的氧化物对应水化物的酸性比N强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
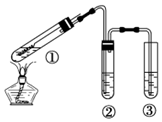
| A. | ②中选用品红溶液验证SO2的生成 | |
| B. | ③中选用NaOH溶液吸收多余的SO2 | |
| C. | 为确认有CuSO4生成,向①中加水,观察颜色 | |
| D. | 上下移动①中铜丝可控制SO2的产生与停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的分子式为SiO2 | B. | 2-丁烯的键线式: | ||
| C. | 丙烷分子的球棍模型示意图: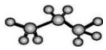 | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com