
下列物质的量浓度关系不正确的是
A.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3·H2O③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>②
B.将0.1 mol·L-1的NaHS和0.1 mol·L-1Na2S溶液等体积混合:c(S2-)+2c(OH-)=2c(H+)+ c(HS-)+3c(H2S)
C.将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液:c(CH3COO-)+c(OH-)=0.10 mol·L-1
D.已知HClO+Na2CO3=NaClO+NaHCO3,在等物质的量浓度等体积次氯酸溶液与碳酸钠溶液混合溶液中:c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-)
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
只用一种试剂就能将AgNO3、KSCN、稀硫酸、NaOH四种无色溶液区分开来的是
A.BaCl2溶液 B.Na2CO3溶液 C.Fe(NO3)3溶液 D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.常温下电离常数为Ka的酸HA 溶液中 c (H+)= mol·L-1
mol·L-1
B.0.2mol·L-1 CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
D.常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:填空题
(13分)X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。
请回答下列问题:
(1)Z3+离子的核外电子排布式是 。
(2)科学家成功地在高压下将XY2 转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是 ;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是 。(填化学式)
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是 。

(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是 。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.用饱和硫酸铵溶液沉淀蛋白质
B.用生石灰干燥氨气
C.用铝制的容器盛装浓硫酸
D.用饱和碳酸钠溶液收集实验室制取的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分馏、蒸馏、煤的液化都是物理变化,干馏、裂化、裂解都是化学变化
B.乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色
C.需要加热的反应不一定是吸热反应
D.根据是否具有丁达尔效应, 将分散系分为溶液、浊液和胶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:选择题
相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g) 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
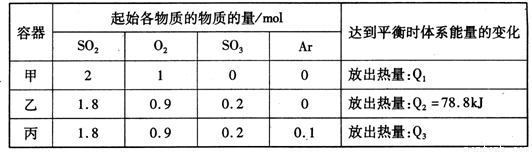
下列叙述正确的是
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)= mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.标况下,1.12LCl2溶于水,转移0.05NA电子
B.向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3·H2O
C.常温下,由水电离出的H+浓度为10-13mol·L-1的溶液中,Fe2+、Cl-、:Na+、NO3-可能大量共存
D.葡萄糖(C6H12O6)溶液中:SO42-、MnO42-、K+、H+可以大量共存
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三下学期第一次模考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
I.S4N4的结构如图:

(1)S4N4的晶体类型是__ _。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3= S4N4 +S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是__ _。
a.离子键
b.极性键
c.非极性键
d.金属键
e.配位键
f.范德华力
②S2Cl2中,S原子轨道的杂化类型是 __ __。
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:

(3)基态Cu2+的最外层电子排布式为_ _。
(4)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是 _ 。
(5)lmol二甘氨酸合铜(II)含有的二键数目是 _ 。
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是 ______(填写编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com