
| A. | H2SO4 | B. | NaOH | C. | CuCl2 | D. | MgSO4 |
分析 A.钠与硫酸反应生成硫酸钠和氢气;
B.钠与氢氧化钠溶液反应实质是与水反应;
C.钠与氯化铜溶液反应,实质是钠与水反应生成氢氧化钠和氢气,氢氧化钠再与氯化铜反应生成氢氧化铜沉淀;
D.钠与硫酸镁溶液反应,实质是钠与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸镁反应生成氢氧化镁沉淀;
解答 解:A.钠与硫酸反应生成硫酸钠和氢气,没有沉淀生成,故A错误;
B.钠与氢氧化钠溶液反应实质是与水反应生成氢氧化钠和氢气,没有沉淀生成,故B错误;
C.钠与氯化铜溶液反应生成氢氧化铜蓝色沉淀,氢气和氯化钠,故C错误;
D.钠与硫酸镁溶液反应生成氢氧化镁白色沉淀,氢气和硫酸钠,故D正确;
故选:D.
点评 本题考查了钠的性质,明确钠与盐溶液反应实质是钠先与水反应,生成的氢氧化钠再与盐发生复分解反应,据此解答.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
 已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸,其合成路线如图所示.
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸,其合成路线如图所示.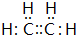
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热 | |
| B. | 在101kP时1mol物质燃烧时所放出的热量叫做该物质的燃烧热 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 在相同条件下,1 molH20(l)完全分解吸收的热量与H2、O2化合生成1 molH2O(g)放出的热量数值相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
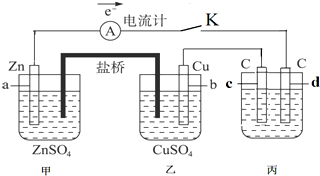
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用下图表示的一些物质或概念间的从属关系中不.正确的是( )
用下图表示的一些物质或概念间的从属关系中不.正确的是( )| X | Y | Z | |
| A | 强电解质 | 电解质 | 化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 置换反应 | 氧化还原反应 | 离子反应 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
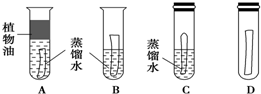
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T(℃) | n (C)/n | P(MPa) |
| Ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| Ⅱ | 150 | $\frac{1}{3}$ | 5 |
| Ⅲ | 350 | $\frac{1}{3}$ | 5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com