
铜是一种与人类关系非常密切的有色金属。常温下,Cu2+在溶液中稳定, Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;大多数 +1价铜的化合物是难溶 物,如:Cu20、Cul、CuCl、CuH 等。
(1)在CuCl2溶液中逐滴加入过量KI溶液,可能发生的反应有:
2Cu2++4I-=2CuI↓(白色)+I2; 2Cu2++4I-+2Cl-=CuCl↓(白色)+I2
已知:常温下Ksp(CuCl)=1.20×10-6(mol/L)2; Ksp(CuI)=5.06×10-12(mol/L)2。 由此推断上述反应生成主要沉淀物的化学式是______。
(2)向CuH中加入过量稀HC1,有气体生成,该反应的离子方程式为______。
(3)将 冰 铜(由Cu2S和FeS熔合成含Cu 18%—20%的一种物质)加入熔剂,在髙温下 吹入空气,冰铜中的Cu2S被氧化为Cu2O,生 成 的Cu2O与Cu2S反应生成粗铜。上述两个反应的化学方程式分别是______、______。
(4)常温下,向0.20 mol • L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜 沉淀,当溶液的pH = 6时,c(Cu2+)=______mol.L‑1。[已知:Ksp(CuI)=2.2×10-20(mol/L)3]
(5)将0.80 gCuSO4 • 5H2O样品加热分解,其脱水过程中固体质量随温度的变化如下图所示。
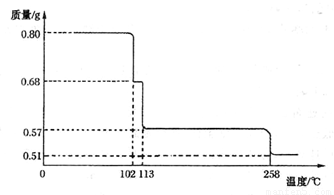
请 确定110°C时固体物质的化学式____________。(要求写出推断过程)
(14分)
(1)CuI(2分)
(2)2CuH+2H+= Cu2++ Cu+2H2↑(2分)
(3)2Cu2S+3O2 2Cu2O+2SO2(2分);2Cu2O+Cu2S
2Cu2O+2SO2(2分);2Cu2O+Cu2S 6Cu+SO2↑(2分)
6Cu+SO2↑(2分)
(4)2.2×10-4 (2分)
(5)设110℃时固体物质的化学式为CuSO4·xH2O,依据题意得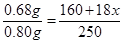 ,解得x=3,该固体物质的化学式为CuSO4·3H2O。(关系式2分,结果2分,共4分,其它合理解法不扣分)
,解得x=3,该固体物质的化学式为CuSO4·3H2O。(关系式2分,结果2分,共4分,其它合理解法不扣分)
【解析】
试题分析:(1)由于CuI的Ksp较小,且加入过量KI溶液,假设生成CuCl也会转化为CuI,所以最终生成CuI
(2)Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;所以发生反应2CuH+2H+= Cu2++ Cu+2H2↑
(3)根据信息提示,注意硫元素燃烧后生成SO2,根据质量守恒定律,写出方程。见答案
(4)由pH = 6知C(OH-)=10-8mol/L,代入Ksp=c(Cu2+)C(OH-)2公式既得结果
(5)见答案
考点:考查沉淀溶解平衡,物质性质,方程式的书写以及计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| ||
| ||
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)c(Cu
| ||
c[Cu
|
c(Cu
| ||
c[Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A.赤潮的发生是一种与人类活动关系不大的自然现象
B.含磷洗涤剂的广泛使用是发生赤潮的主要原因之一
C.在封闭的海湾更易发生赤潮
D.赤潮是水体富营养化的结果
查看答案和解析>>
科目:高中化学 来源:2014届江西省高三上学期第二次月考化学试卷(解析版) 题型:填空题
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。
 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b= 。
③若反应中转移0.6mol电子,则生成的气体在标况下的体积是 。
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为 。
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因。
①产生蓝色沉淀的离子方程式为 ,②后又变黑色沉淀的离子方程式为 。
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+= Cu+ Cu2+。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
①写出CuH在过量稀盐酸中有气体生成的离子方程式 。
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式:

查看答案和解析>>
科目:高中化学 来源:2014届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。

①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com