
| A. | ①③⑤ | B. | ②④ | C. | ②⑤⑥ | D. | ④⑤ |
分析 ①0.1mol•L-1NaAlO2溶液,显碱性,与H+反应生成沉淀;
②pH=11的溶液,显碱性,该组离子之间不反应;
③水电离的H+浓度为10-12mol•L-1的溶液,为酸或碱溶液;
④加入Mg能放出H2的溶液,显酸性;
⑤使甲基橙变黄的溶液,可能显碱性;
⑥中性溶液中不能大量存在Fe3+,且Fe3+、S2-发生氧化还原反应.
解答 解:①0.1mol•L-1NaAlO2溶液,显碱性,与H+反应生成沉淀,发生复分解反应不能大量共存,故不选;
②pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故选;
③水电离的H+浓度为10-12mol•L-1的溶液,为酸或碱溶液,酸性溶液中不能大量存在CO32-、SO32-,故不选;
④加入Mg能放出H2的溶液,显酸性,该组离子之间不反应,可大量共存,故选;
⑤使甲基橙变黄的溶液,可能显碱性,碱性溶液中不能大量存在Fe2+,故不选;
⑥中性溶液中不能大量存在Fe3+,且Fe3+、S2-发生氧化还原反应,不能大量共存,故不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:填空题
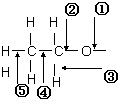 乙醇分子中各化学键如图所示:
乙醇分子中各化学键如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化三碳的电子式为:O::C::C::C::O: | |
| B. | C3O2、CO、CO2都是碳的氧化物 | |
| C. | C3O2和CO一样可以燃烧生成CO2 | |
| D. | C3O2不是碳酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.由图中所给数据进行分析:
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.由图中所给数据进行分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②④ | C. | 只有①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ═CH-CHO
═CH-CHO +CO$→_{氢化铝}^{HCl}$
+CO$→_{氢化铝}^{HCl}$

 +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$ .
.
 $→_{反应条件1}^{G}$H$\stackrel{浓硫酸}{→}$
$→_{反应条件1}^{G}$H$\stackrel{浓硫酸}{→}$ 试剂G的结构简式是CH3CH2CHO.
试剂G的结构简式是CH3CH2CHO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:2c(CO${\;}_{3}^{2-}$)+c(OH-)+c(HCO${\;}_{3}^{-}$)-c(H+)=0.1mol•L-1 | |
| B. | 浓度均为0.1mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO${\;}_{4}^{2-}$)>c(Na+)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| C. | pH=12的氨水与pH=2的盐酸等体积混合c(Cl-)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1的醋酸溶液与氢氧化钠溶液等体积混合c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所占硫原子的物质的量之比为1:1 | B. | 氧原子的物质的量之比为2:3 | ||
| C. | 氧元素的质量比为2:3 | D. | 体积比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com