
(8分)某100mL的CuCl2溶液中,已知溶液中的Cl-的浓度为0.2 mol·L-1。现将一定量的铁粉投入到该溶液中,回答下列问题:
(1)原溶液中Cu2+的浓度为 ;
(2)反应后测得Cl-的浓度为 mol·L-1;
(3)若反应后测得Fe2+的溶液为0.05 mol·L-1,则反应生成铜单质的质量为 g;
(4)剩余的Cu2+的浓度为 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2011-2012学年福建省南安一中高一下学期期末考试化学试卷(带解析) 题型:填空题
(本小题满分8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 0 | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源:2010年福建省季延中学高一下学期期末考试化学试题 题型:实验题
(8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态)):
 时间(min) 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
 原因是 。
原因是 。 (2)哪一段时段的反应速率最小 ,原因是
(2)哪一段时段的反应速率最小 ,原因是  。
。 (3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变) 。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变) 。 (4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
| A.蒸馏水 | B.NaCl溶液 | C.Na2CO3溶液 | D.CuSO4溶液 |
 你认为可行的是(填编号) 。
你认为可行的是(填编号) 。查看答案和解析>>
科目:高中化学 来源:2014届福建省高一下学期期末考试化学试卷(解析版) 题型:填空题
(本小题满分8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
|
时间(min) |
0 |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
0 |
50 |
120 |
232 |
290 |
310 |
(1)哪一段时段的反应速率最快 ,原因是 。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变) 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号) 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江省高三上学期期中考试化学试卷 题型:填空题
(8分)请回答下列各问:
(1)酸雨的pH范围是 ,在空气质量报告的各项指标中有可吸入颗粒物,还有 。
(2)石灰法是目前应用最广泛的工业废气脱硫方法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂在吸收塔中与废气中的SO2反应而将硫固定,写出反应的化学方程式 。
(3)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu  CuO
CuO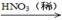 Cu(NO3)2
Cu(NO3)2
(4)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.40.32L B.30.24L C.20.16L D.13.44L
(5)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com