
 是由含有一个三键的炔烃与氢气加成后的产物,此炔烃可能的结构有( )
是由含有一个三键的炔烃与氢气加成后的产物,此炔烃可能的结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.根据加成原理采取逆推法还原C≡C双键,烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置.还原三键时注意:先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子的2个氢原子还原C≡C.
解答 解:根据炔烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置.该烷烃的碳链结构为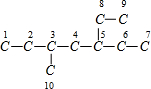 ,3、5号碳原子上有1个H原子,不能与相邻的碳原子形成C≡C
,3、5号碳原子上有1个H原子,不能与相邻的碳原子形成C≡C
,能形成三键位置有:1和2之间;6和7之间,8和9之间,6和7与8和9形成的碳碳三键位置相同,故该炔烃共有2种.
故选B.
点评 本题以加成反应为载体,考查同分异构体的书写,理解加成反应原理是解题的关键,采取逆推法还原C=C双键,注意分析分子结构是否对称,防止重写、漏写,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 铝热反应属于放热反应,反应物的总能量比生成物的总能量低 | |
| C. | 图I所示的装置可以实现将化学能转变为电能 | |
| D. | 图II所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟二化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42﹣、NO3﹣
B.常温下由水电离出的H+与OH﹣的浓度积为10﹣20mol2•L﹣2的溶液中可能大量共存的离子组:Na+、S2﹣、Cl﹣、CO32﹣
C.向FeI2溶液中通入过量Cl2的离子方程式:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
D.Ca(ClO)2溶液中通入少量CO2 的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分子有8个σ键,5个π键 | |
| B. | 该分子中碳原子有sp和sp2杂化 | |
| C. | 该分子存在非极性键 | |
| D. | 该分子中有8个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝是中学化学中常见的金属元素,具有广泛用途.
铝是中学化学中常见的金属元素,具有广泛用途. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称是 3,3,6-三甲基-4-乙基庚烷 的名称是 3,3,6-三甲基-4-乙基庚烷 | |
| B. | CH3CH2OCHO 与 CH3CH2OCH2CHO 互为同系物 | |
| C. | 含有羟基和羧基的有机物都易溶于水,醛类不含羟基和羧基故水溶性较差 | |
| D. | CH2=CH-CHO 中滴加溴的四氯化碳溶液,溶液褪色,说明该物质中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 115号元素在周期表中的位置是第七周期VB | |
| B. | 这四种元素都是主族元素 | |
| C. | 118号元素在通常情况下呈气态,其余三种为固态 | |
| D. | 117号元素Ts位于金属非金属分界线上,可能是半导体,与它同族的上一周期元素的原子序数为99 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com