
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn+2K2FeO4+8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
A.放电时负极反应为:Zn-2e—+2OH—=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e—+ 5OH—=FeO42-+ 4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
一定温度下,对于反应N2+O2  2NO在密闭容器中进行,下列措施一定能加快反应速率的是:( )
2NO在密闭容器中进行,下列措施一定能加快反应速率的是:( )
A.使压强增大 B.恒容,充入N2
C.恒容,充入He气 D.恒压,充入He气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
下列电离方程式正确的是
A.H2SO4 = 2H+ + S6+ + 4O2- B.H2CO3 = 2H+ + CO32-
C.Ba(OH)2 = Ba2+ + 2OH- D.Na2CO3 = Na2+ + CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
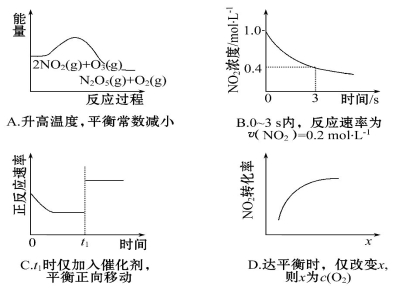
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)  2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4 mo1SO2和2mol O2
B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2.和4 mo1 O2
D.6mo1 SO2和4 mo1 O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.合成氨工厂通常采用20 MPa-50 MPa压强,以提高原料的利用率
C.实验室用排饱和食盐水的方法收集氯气
D.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:实验题
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
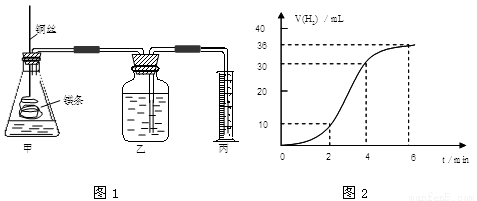
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。
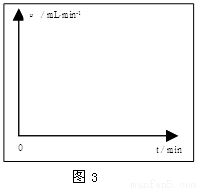
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因: 。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ: ;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: 。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量 固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量 固体,观察反应速率是否变化。
通过观察到实验a和实验b现象,从而得出结论。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3溶液 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:填空题
(11分)(1)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+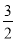 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。
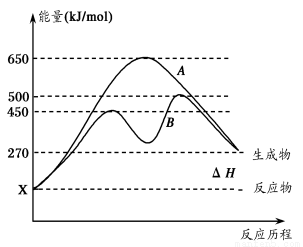
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+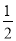 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com