
分析 (1)①根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
②锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
③根据物质的性质和书写离子方程式的有关要求书写离子方程式;
④根据离子方程式计算,n(Fe)=5n(MnO4-)=5×$\frac{20.02ml+19.98ml}{2}$×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=$\frac{0.56g}{5g}$×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g.
解答 解:(1)①在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤,
故答案为:溶解;定容;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,
故答案为:将Fe3+恰好还原成Fe2+;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×$\frac{20.02ml+19.98ml}{2}$×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=$\frac{0.56g}{5g}$×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,
故答案为:11.2%;偏高;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g,
故答案为:加热后的晶体要在干燥器中冷却; 两次称量质量差不超过0.1 g.
点评 本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
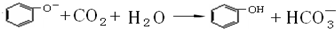 ,该反应说明苯酚具有的性质是弱酸性.
,该反应说明苯酚具有的性质是弱酸性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
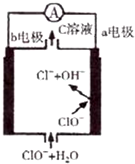 镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )
镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )| A. | 电池工作时,正极a附近的pH将不断增大 | |
| B. | 电池工作时,C溶液中的溶质是MgCl2 | |
| C. | 负极反应式:ClO-+2e-+H2O=Cl-+2OH- | |
| D. | b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯 | |
| B. | 用盐酸酸化的高锰酸钾溶液区别苯与甲苯 | |
| C. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋白溶液中分散质的微粒直径在1~100 nm之间 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 | |
| D. | 在河流入海处易形成沙洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | N2O | C. | N2O4 | D. | N2O5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com