
下表所列是元素周期表部分短周期的主族元素
| | W | X | Y | |
| R | | | | Z |
 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(15分)
(1)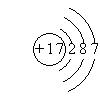 (2分)
(2分)
(2)CH2=CH2 (2分)
(3)Al2O3+N2+3C 2AlN+3CO(3分)
2AlN+3CO(3分)
(4)c(NO3—)>c(NH4+)>c(H+)>c(OH-) (顺序错,漏均不得分)(2分)
(5)2N2H4(l) + N2O4(l)= 3N2(g) + 4H2O(g) ΔH="—873.4" kJ/mol(3分)
(6) <(1分)
因为Qc=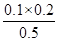 >K=
>K= 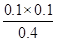 ;所以逆反应速率大于正反应速率。(2分)
;所以逆反应速率大于正反应速率。(2分)
解析试题分析:(1)地壳中含量最多的金属元素是Al,则R、W、X、Y、Z分别是铝、碳、氮、氧、氯,Cl原子核内核电荷数为+17,核外电子层结构为287;(2)碳和氢形成烃,6原子烃分子为乙烯,乙烯的结构简式为CH2=CH2;(3)根据题意,Al2O3、N2、C在高温下反应,可以生成AlN、CO,则反应式为Al2O3+N2+3C 2AlN+3CO;(4)根据题意,HNO3与NH3反应,生成NH4NO3,NH4NO3是盐,根据电解质的电离、盐类水解规律可知,溶液中c(NO3—)>c(NH4+)>c(H+)>c(OH-);(5)根据盖斯定律,由②×2—①可得,2N2H4(l) + N2O4(l)= 3N2(g) + 4H2O(g) ΔH="—873.4" kJ/mol;(6)根据图表可知,
2AlN+3CO;(4)根据题意,HNO3与NH3反应,生成NH4NO3,NH4NO3是盐,根据电解质的电离、盐类水解规律可知,溶液中c(NO3—)>c(NH4+)>c(H+)>c(OH-);(5)根据盖斯定律,由②×2—①可得,2N2H4(l) + N2O4(l)= 3N2(g) + 4H2O(g) ΔH="—873.4" kJ/mol;(6)根据图表可知,
PCl5(g) PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
各组分的起始浓度(mol?L—1) 0.50 0 0
各组分的变化浓度(mol?L—1) 0.10 0.10 0.10
各组分的平衡浓度(mol?L—1) 0.40 0.10 0.10
平衡时K=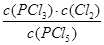 =
=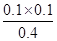
温度不变,平衡常数不变,若起始时充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,则三者的起始浓度为0.5mol/L、0.10mol/L、0.20mol/L,Q=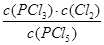 =
=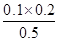 >
>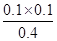 ,说明此时反应必须向逆反应方向进行,才能达到该温度下的化学平衡,所以此时逆反应速率大于正反应速率。
,说明此时反应必须向逆反应方向进行,才能达到该温度下的化学平衡,所以此时逆反应速率大于正反应速率。
考点:考查物质结构和元素周期律、氧化还原反应、质量守恒定律、铝氮碳氧元素及其化合物、盐类水解、电解质溶液中离子浓度大小关系、热化学方程式、盖斯定律、化学平衡的计算与化学反应进行的方向等相关知识。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是原子半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填写编号)
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)C、D两元素形成的原子个数比为1:1的化合物与C、E两元素形成的两种化合物都能反应,且有一种共同的产物,写出这两个反应的化学方程式: ; 。
(3)某工业生产的核心反应是 :2EC2(g) + C2(g)  2EC3(g) △H<0,回答下列问题:
2EC3(g) △H<0,回答下列问题:
①此反应的平衡常数表达式为K= ,随着温度的升高,上述平衡常数
(填“增大”、“减小”或“不变”)。
②将一定量的EC2(g)和C2(g)放入1L密闭容器中,在一定条件下达到平衡,测得EC2为0.11mol,C2为0.05mol,EC3为0.12mol。计算该条件下,反应的平衡常数K= 。EC2的转化为EC3转化率= 。
(4)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(5)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol.液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
②B2A4又称为肼,是一种可燃性液体,肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液,该电池放电时的电极反应式为:正极 ,负极
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A | |
| | C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 。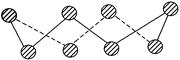
(2)Se原子在元素周期表中位置为 ;
其基态原子核外价电子的轨道表示式为 。
(3)气态SeO3分子的立体构型为 。
(4)H+可与H2O形成H3O+,H3O+中存在的共价键类型为: 。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)写出下列溶液中溶质的化学式
A___________,C_______________,E______________,F_________________。
(2)E的浓溶液与Cu应的化学方程式是______________________________________________________;该反应中氧化剂与还原剂的物质的量之比为____________;该反应的还原产物与少量B溶液反应的离子方程式是_____________________________________________________________________________。
(3)如何通过实验进一步确定D溶液的溶质?写出简要的操作及现象_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、T是元索周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X是地壳中含量最多的元素 |
| Y | Y元素原子核外3p能级上有4个电子 |
| Z | 核素Z的质量数为14、中子数为7 |
| T | T的单质是一种常见的金属,其新制的氢氧化物悬浊液可用于检验糖尿病 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是___。
| A.14N与15N为同种核素 |
| B.14N的第一电离能小于14C |
| C.15NH3与14NH3均能形成分子间氢键 |
| D.CH315NH2与CH3CH214NH2互为同系物 |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题: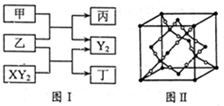
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中, 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com