
 ����ҵ�Ϻϳɰ�����һ�������½������·�Ӧ��N2��g��+3H2��g��
����ҵ�Ϻϳɰ�����һ�������½������·�Ӧ��N2��g��+3H2��g��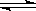 2NH3��g�����䲿�ֹ����������£�
2NH3��g�����䲿�ֹ����������£� |






 �ش��������⣺
�ش��������⣺ ����֪��N2(g)+O2(g) =2NO(g)����H=180.5kJ/mol
����֪��N2(g)+O2(g) =2NO(g)����H=180.5kJ/mol 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ����H=-905kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ����H=-905kJ/mol 2H2(g)+O2(g)=2H2O(g) ����H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(g) ����H=-483.6kJ/mol ��N2��g��+3H2��g��
��N2��g��+3H2��g��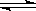 2NH3��g���ġ�H=_________________��
2NH3��g���ġ�H=_________________��


 ��2������ó������İ�ˮ��pH=a��������ͬ���������ʱ����Һ�����ԣ���������pH_________14��a����ʱc(NH4+)________c(Cl-)(����ڡ���С�ڡ����ڡ�)��
��2������ó������İ�ˮ��pH=a��������ͬ���������ʱ����Һ�����ԣ���������pH_________14��a����ʱc(NH4+)________c(Cl-)(����ڡ���С�ڡ����ڡ�)�� д����ʾN2H4ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
д����ʾN2H4ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
|

 ��1����92.4kJ/mol
��1����92.4kJ/mol ����
����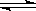 2NH3��g���ġ�H=180.5kJ/mol+[-��-905kJ/mol��1/2��]+[-483.6kJ/mol��3/2]=��92.4kJ/mol
2NH3��g���ġ�H=180.5kJ/mol+[-��-905kJ/mol��1/2��]+[-483.6kJ/mol��3/2]=��92.4kJ/mol

 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


| A����Ӧ���е�3minʱ�ﵽ��ѧƽ��״̬ |
| B���Ƿ�ʹ�ô����Է�Ӧǰ��������仯û��Ӱ�� |
| C������Ӧ��������һ��ʱ������Ӧ����Һ̬�״��������仯ֵ����� |
| D��ƽ��ʱ������Ũ��Ϊ1mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2HI(g)��H��0,���ﵽƽ�⡣HI���������w(HI)��ʱ��t�仯��ͼ����(��)��ʾ��
2HI(g)��H��0,���ﵽƽ�⡣HI���������w(HI)��ʱ��t�仯��ͼ����(��)��ʾ��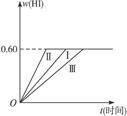
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB(g)�ﵽ�ȵı�־�ǣ� ��
2AB(g)�ﵽ�ȵı�־�ǣ� ��| A����λʱ��������n mol A2ͬʱ����n mol AB |
| B�������ڵ������ʵ�������ʱ��仯 |
| C����λʱ��������2n mol AB��ͬʱ����n mol B2 |
| D����λʱ��������n mol A2��ͬʱ����n mol B2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
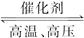 2NH3��g��;��H=-92��4 kJ��mol-1��
2NH3��g��;��H=-92��4 kJ��mol-1��
| A��һ����� | B��ǰ��һ��С |
| C��ǰ�ߴ��ڻ���ں��� | D������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ���ʣ��ң��� | B��ƽ���N2��Ũ�ȣ��ң��� |
| C��H2��ת���ʣ��ң��� | D��ƽ��������H2������������ң��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
|
A��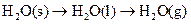 | B��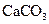 �T�T �T�T 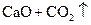 | C��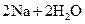 �T�T �T�T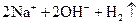 | D��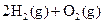 �T�T �T�T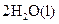 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO(g)+6H2O(g)��10L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45mol����˷�Ӧ��ƽ������
4NO(g)+6H2O(g)��10L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45mol����˷�Ӧ��ƽ������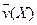 ����Ӧ����������ʻ������������ʣ��ɱ�ʾΪ�� ��
����Ӧ����������ʻ������������ʣ��ɱ�ʾΪ�� ��A��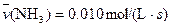 | B��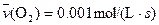 |
C��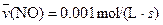 | D��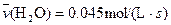 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com