
| A. | 一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构 | |
| B. | 构成乙烯分子的所有原子都在同一平面内,其分子中只含有极性键 | |
| C. | 邻二甲苯没有同分异构体表明苯的凯库勒结构式存在局限,不准确 | |
| D. | 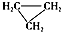 和CH3-CH═CH2互为同分异构体 和CH3-CH═CH2互为同分异构体 |
分析 A.正四面体结构的甲烷二卤代物只有一种结构;
B.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键;
C.苯的凯库勒结构式中邻二甲苯有同分异构体;
D.分子式相同结构不同的有机物互称同分异构体.
解答 解:A.若甲烷是正方形的平面结构,而一氟一氯甲烷有两种结构:相邻或者对角线上的氢未被Cl取代,而实际上,一氟一氯甲烷只有一种结构,因此只有正四面体结构才符合,故A正确;
B.乙烯中C-C原子之间存在非极性键、C-H原子之间存在极性键,故B错误;
C.苯的凯库勒结构式中邻二甲苯有同分异构体,实际上邻二甲苯没有同分异构体,故C正确;
D. 和CH3-CH═CH2分子式相同结构式不同,互为同分异构体,故D正确.
和CH3-CH═CH2分子式相同结构式不同,互为同分异构体,故D正确.
故选B.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系即可解答,侧重考查基本概念及物质结构,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
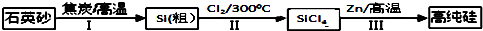
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①④⑤ | C. | ①⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于共价化合物 | B. | 属于有机物 | C. | 属于单质 | D. | 属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加酸性高锰酸钾溶液,振荡 | B. | 加NaOH溶液,加热 | ||
| C. | 加新制氢氧化铜悬浊液,加热 | D. | 加Na2CO3溶液,加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com