
| 1 |
| 2 |
| 1 |
| 2 |
| Fe元素质量 |
| 混合物总质量 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.224L |
| 22.4L/mol |
| 2.8g |
| 2.8g+0.64g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、纯碱、小苏打和生石灰分别属于酸、碱、盐和氧化物 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、金属原子只有还原性,金属阳离子只有氧化性 |
| D、用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠加入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | ||
B、金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO
| ||
| C、铁粉加入到FeCl3溶液中:Fe+2Fe3+═3Fe2+ | ||
| D、铜片插入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液盛装在用橡胶塞的试剂瓶中 |
| B、氢氟酸盛装在细口玻璃瓶中 |
| C、硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |
| D、金属钠保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
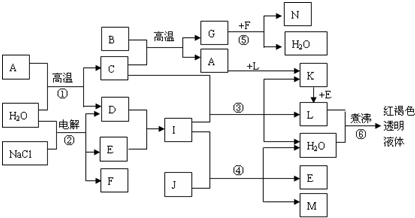

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| B、在0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、向0.2 mol?L-1NaHCO3溶液中加入等体积0.1 mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol?L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com