
【题目】煅烧铵明矾晶体时发生的主要反应为:4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3+N2↑+2NH3↑+3SO2↑+53H2O+5SO3↑,将产生的气体通过如图所示的装置(广口瓶中的试剂均足量)。
2Al2O3+N2↑+2NH3↑+3SO2↑+53H2O+5SO3↑,将产生的气体通过如图所示的装置(广口瓶中的试剂均足量)。
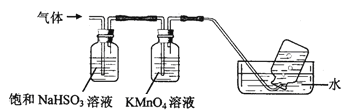
(1)集气瓶中最终收集到的气体是______ (填化学式,下同)。
(2)通过足量饱和NaHSO3溶液后大量减少的气体有______ 。
(3)KMnO4溶液颜色逐渐褪去,发生反应的离子方程式为______ 。
(4)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,反应后溶液中溶质的成分不可能是______ (填字母)。
A.(NH4)2SO4、Al2(SO4)3 B.(NH4)2SO4
C.(NH4)2SO4、Ba(AlO2)2 D.(NH4)2SO4、Al2(SO4)3、Ba(OH)2
【答案】 N2 NH3、SO3(或NH3、SO3、H2O) 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ CD
【解析】分析:煅烧铵明矾晶体,生成的混合气体是氨气、氮气、二氧化硫和三氧化硫。通入饱和的亚硫酸氢钠溶液中,氨气和三氧化硫溶解,剩余气体通入高锰酸钾溶液,二氧化硫被氧化生成硫酸根离子,剩余的氮气采用排水法收集,据此解答。
详解:(1)煅烧铵明矾晶体,生成的混合气体是氨气、氮气、二氧化硫和三氧化硫。通入饱和的亚硫酸氢钠溶液中,氨气和三氧化硫溶解,剩余气体通入高锰酸钾溶液,二氧化硫被氧化生成硫酸根离子,剩余的氮气采用排水法收集,因此集气瓶中最终收集到的气体是N2。
(2)氨气是碱性气体,三氧化硫溶于水生成硫酸,溶液显强酸性,因此通过足量饱和NaHSO3溶液后大量减少的气体有NH3、SO3。
(3)二氧化硫具有还原性,能使KMnO4溶液颜色褪去,发生反应的离子方程式为5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+。
(4)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,生成硫酸钡沉淀,氢氧根离子首先结合铝离子生成氢氧化铝沉淀,然后结合铵根生成一水合氨,氢氧化钡过量后氢氧化铝溶解生成偏铝酸盐。由于钡离子与硫酸根离子以及铵根、铝离子与氢氧根离子均不能大量共存,所以反应后溶液中溶质的成分不可能(NH4)2SO4、Ba(AlO2)2或(NH4)2SO4、Al2(SO4)3、Ba(OH)2,答案选CD。


科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
B. 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA
C. NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA
D. 1 mol Fe在氧气中充分燃烧失去3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的键线式结构为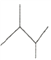 ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法正确的是
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法正确的是
A. 有机物A的一氯取代物有3种
B. 有机物A的名称为2,3—二甲基戊烷
C. 有机物B与CH≡C-(CH2)3—CH3互为同分异构体
D. B的结构可能有2种,其中一种化学名称为2,3-二甲基-2-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
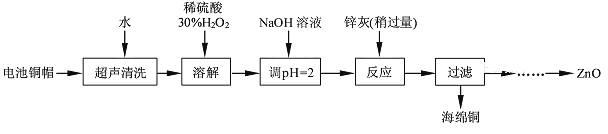
(1)铜帽溶解时加入H2O2的目的是_________________________(用化学方程式表示)。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2;2S2O32-+I2=2I-+S4O62-。
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为_______________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会_______(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30%H2O2,使其充分反应;②滴加1.0mol·L-1NaOH,调节溶液pH范围:________;③过滤;④向滤液中滴加1.0mol·L-1NaOH,调节溶液pH范围:___________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中只可能含有H+、Na+、NH4+、Cu2+、Al3+、Ag+、Fe3+、CO32-、NO3-、SO42-中的一种成几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
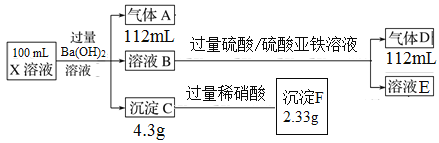
(1)X溶液中一定不存在的离子是________。
(2)加入过量H2SO4/FeSO4溶液时,发生反应的离子方程式为________。
(3)X溶液中c(CO32-)=_____mol/L,c(Na+)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列化学用语正确的是
A. 氯化氢的电子式: ![]() B. 质了数为30,中子数为35的锌原子:6535Zn
B. 质了数为30,中子数为35的锌原子:6535Zn
C. 乙酸的结构简式:CH3COOH D. 四氯化碳的比例模型: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的一些物质或概念间的从属关系中不正确的是( )
![]()
A. X为含氧酸、Y为酸、Z为化合物
B. X为氧化物、Y为化合物、Z为纯净物
C. X为强碱、Y为碱、Z为化合物
D. X为非金属氧化物、Y为酸性氧化物、Z为氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式____________________ 。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为 _____________。
②NaH2PO2为________(填 “正盐”或“酸式盐”),其溶液显______(填“弱酸性”、 “中性”或“弱碱性”)。
③利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产 物为_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)
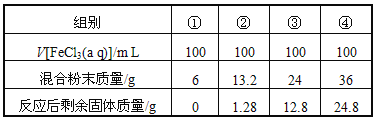
有关说法不正确的是( )
A. 第①组溶液中c(Fe3+)=2.0 mol/L
B. 第②组剩余固体只有铜
C. 第③④组反应后的滤液中c(Fe2+)=6 mol/L
D. 原混合粉末中n(Fe):n(Cu)=11:9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com