
某CuO粉末与适量硫酸(ρ=1.7g/cm3)在微热下充分反应(设反应过程中无水份损失),冷却后恰好全部形成CuSO4·xH2O,若此硫酸溶液的物质的量浓度为10.8mol/L,则x为( )
A.3.3 B.4.3 C.5 D.5.3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
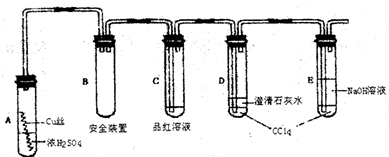
| ||
| ||
| ||
 Cu(OH)2+2H+
Cu(OH)2+2H+ Cu(OH)2+2H+
Cu(OH)2+2H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
| 实验步骤 | 实验操作 | 实验操作的目的 |
| 步骤1 | 加入H2O2 加入H2O2 |
把二价铁氧化成三价 把二价铁氧化成三价 |
| 步骤2 | 加入适量氧化铜,调节pH到3.7 加入适量氧化铜,调节pH到3.7 |
保证三价铁完全沉淀 保证三价铁完全沉淀 |
| 步骤3 | 过滤 过滤 |
滤出氢氧化铁 滤出氢氧化铁 |
| 步骤4 | 洗涤 | 除去杂质 除去杂质 |
| 步骤5 | 向沉淀中加入适量稀硫酸和适量铁粉 向沉淀中加入适量稀硫酸和适量铁粉 |
得到FeSO4溶液 |
| 144n |
| 64m |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学用含硫酸亚铁等杂质的工业硫酸铜制取纯净的氧化铜以探究其性质。
(1)制备氧化铜
①将工业硫酸铜加适量水溶解、搅拌、过滤除去不溶性杂质。简述检验滤液中含有Fe2+的操作方法: 。
②向滤液中滴加H2O2溶液,稍加热,当Fe2+转化完全后,为将Fe3+全部转化为Fe(OH)3沉淀,而不会将Cu2+转化为沉淀,需慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5。加热煮沸后过滤,用稀硫酸酸化滤液至pH=1。再从溶液中分离出硫酸铜晶体。Fe2+转化为Fe3+的离子方程式是 。
③在测定所得硫酸铜晶体(CuSO4·xH2O)x值的实验中,所用的玻璃仪器名称为:酒精灯、
玻璃棒、 ,实验过程中称量操作至少进行 次。
④用得到的硫酸铜晶体制氧化铜。
(2)探究氧化铜的性质
在加热条件下,向下图所示装置中持续通入某纯净物X的蒸气,a处黑色物质变为红色,b处白色粉末变为蓝色,c处有无色液体产生。(设各步反应均进行完全)
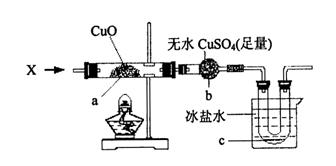
则X可能是 (填一个化学式即可),X与CuO反应的化学方程式是
。
查看答案和解析>>
科目:高中化学 来源:北京期末题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com