
| 电离能 I1 I2 I3 I4 … |
| In/kJ.mol-1 578 1817 2745 11578 … |


科目:高中化学 来源: 题型:
| A、上述测定不能达到实验目的 |
| B、剩余的7.48g金属为铜 |
| C、共生成NO气体0.04mol |
| D、该合金中铜的质量分数为69.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:
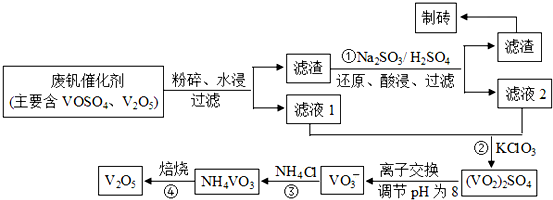
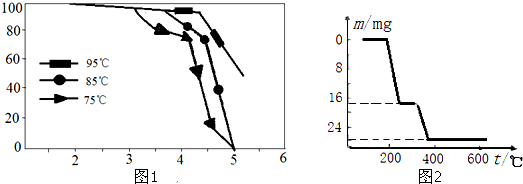
| 物质 | V2O5 | VOSO4 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 难溶 | 可溶 | 难溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液 | B、浓盐酸 |
| C、稀硝酸 | D、硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气中有NOx,主要是汽油不充分燃烧引起的 |
| B、日用铝制品表面覆盖着氧化膜,对金属起保护作用 |
| C、大气中CO2含量的增加会导致温室效应加剧 |
| D、NO2或SO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:16 | B、16:1 |
| C、7:17 | D、7:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、②③④ |
| C、③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 制取少量蒸馏水 |
B、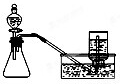 用铜和浓硝酸混合制取少量NO2 |
C、 比较MnO2、Cl2、I2的氧化性 |
D、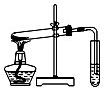 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com