
【题目】镁及其化合物在现代工业、国防建设中有着广泛的应用。回答下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的_____,还生成少量的______(填化学式)。
(2)CH3 MgCl是一种重要的有机合成剂,其中镁的化合价为______,CH3 MgCl水解时除生成甲烷外,还生成一种碱和一种盐。写出该反应的化学方程式:_________________________。
(3)Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3,不考虑杂质)为原料制备Mg(OH)2和CaCO3工艺流程如下:

①溶解度:Ca(OH)2 _______ (填“>”或“<”)Mg(OH)2。
②“煅烧”时称取27.6 g白云石,高温加热到质量不再变化,收集到的CO2为6.72 L(标准状况下),若工艺中不考虑Ca、Mg损失,则Mg( OH)2和CaCO3的质量分别为_________、____________。
【答案】 MgO Mg3N2 +2 2CH3 MgCl+2H2O=2CH4↑+MgCl2 +Mg(OH)2 > 8.7 g 15 g
【解析】试题分析:
(1)镁既能在氧气中燃烧又能在氮气中燃烧,氧气的氧化性比氮气强,所以单质镁在空气中燃烧的主要产物是白色的MgO,还生成少量的Mg3N2。
(2)CH3 MgCl是一种重要的有机合成剂,其中镁的化合价为+2,CH3 MgCl水解时除生成甲烷外,还生成一种碱和一种盐,则该碱一定是氢氧化镁,该盐一定是氯化镁,该反应的化学方程式为2CH3 MgCl+2H2O=2CH4↑+MgCl2 +Mg(OH)2。
(3)①氢氧化钙微溶于水,氢氧化镁难溶于水,所以溶解度:Ca(OH)2 > Mg(OH)2。
②“煅烧”时称取27.6 g白云石,高温加热到质量不再变化,收集到的CO2为6.72 L(标准状况下),则CO2的物质的量为0.3mol。由碳元素守恒可得,n(CaCO3)+n(MgCO3)=0.3mol,100g/mol![]() n(CaCO3)+84 g/mol
n(CaCO3)+84 g/mol![]() n(MgCO3)=27.6g,解之得n(CaCO3) =0.15mol,n(MgCO3)=0.15mol,若工艺中不考虑Ca、Mg损失,则Mg( OH)2的质量为58g/mol
n(MgCO3)=27.6g,解之得n(CaCO3) =0.15mol,n(MgCO3)=0.15mol,若工艺中不考虑Ca、Mg损失,则Mg( OH)2的质量为58g/mol![]() 0.15mol=8.7 g、CaCO3的质量为100g/mol
0.15mol=8.7 g、CaCO3的质量为100g/mol![]() 0.15mol=15 g。
0.15mol=15 g。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】苯与乙烯相比较,下列叙述不正确的是( )
A.都容易发生取代反应
B.苯不能被KMnO4氧化
C.苯只能在特殊条件下发生加成反应
D.都能在空气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NaCl溶液与AgNO3溶液反应的离子方程式中,书写正确的是
A、Ag+ + Cl—=AgCl↓
B、AgNO3 + Cl—= AgCl ↓+ NO3—
C、NaCl + Ag+ = AgCl ↓+ Na+
D、Ag++ NO3—+ Na+ + Cl—=AgCl ↓+ NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A﹣和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.
回答下列问题:
(1)D2+的价层电子轨道示意图为 .
(2)四种元素中第一电离能最小的是
(3)电负性最大的是 . (填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,又名“大苏打”,是无色单斜晶体。易溶于水,不溶于乙醇,具有较强的还原性,广泛地应用于照相等工业中。回答下列问题:
(1)Na2S2O3·5H2O属于______(填“纯净物”或“混合物”)。
(2)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_____。
(3)亚硫酸法制备Na2S2O3·5H2O简易流程如下:
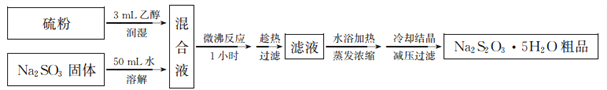
①Na2S2O3·5H2O制备原理为_________________(用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2SO3、Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;将白色沉淀过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量____(填试剂名称),若_______________(填现象),则证明产品中含有Na2SO3和Na2SO4(已知:Na2S2O3稀溶液与BaCl2溶液无沉淀生成)。
③粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250 ml.的溶液待用。另取25 ml.0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________。已知Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O、I2+2S2O32- =2I-+S4O62-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1mol Na与乙醇完全反应,失去2NA电子
B. 常温常压下,8gCH4含有5NA个电子
C. 1L 0.1molL-1的醋酸溶液中含有0.1NA个H+
D. 标准状况下,22.4L苯含有NA个C6H6分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖在不同条件下可以被氧化成不同物质。请结合题意回答问题:已知:RCOOH+CH2===CH2+![]() O2
O2![]() RCOOCH===CH2+H2O
RCOOCH===CH2+H2O
(1)葡萄糖在酒化酶作用下生成有机物A,A、B、C、D、E间的转化关系如下图所示:

①B是石油化学工业最重要的基础原料,写出A→B的化学方程式:___________________________________________。
②D的结构简式为_____________________________。
(2)葡萄糖在一定条件下还可氧化为X和Y(Y和A的相对分子质量相同)。X可催化氧化成Y,也可与H2反应生成Z。X和Y的结构中有一种相同的官能团是________,检验此官能团需用的试剂是________。
(3)F是人体肌肉细胞中的葡萄糖在缺氧的条件下进行无氧呼吸的产物。F、G、H间的转化关系是:F![]() G
G![]() H,H与(1)中的D互为同分异构体。
H,H与(1)中的D互为同分异构体。
①G还可以发生的反应有________(填字母)
a.加成反应 b.水解反应 c.氧化反应 d.消去反应 e.还原反应
②本题涉及的所有有机物中,与F不论以何种质量比混合(总质量一定),完全燃烧生成CO2和H2O的物质的量不变的有(写结构简式)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L 0.2 mol/L的KI溶液中,含溶质KI的物质的量是
A. 0.2 mol B. 0.5 mol C. 2 mol D. 5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充入1 mol N2和3 mol H2,一定条件下反应达平衡。下列说法正确的是
A. 生成2 mol NH3
B. 正反应和逆反应的速率都为零
C. N2、H2和NH3的物质的量浓度相等
D. N2、H2和NH3的物质的量浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com