
【题目】下列实验能说明SO2具有漂白性的是( )
A.SO2 能使氯水褪色
B.SO2能使品红溶液褪色
C.SO2能使溴水褪色
D.SO2 能使酸性KMnO4溶液褪色
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
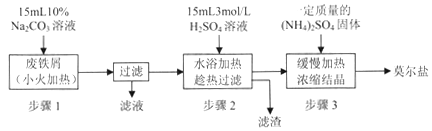
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)![]() xC(?)+3D(?)。反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如下图所示。下列有关说法正确的是
xC(?)+3D(?)。反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如下图所示。下列有关说法正确的是
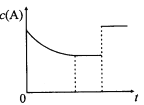
A.x=2,C为气态,D可能为气态也可能为非气态
B.改变的条件可能是使用了催化剂
C.其他条件不变,若向容器中加入少量C,A的平衡转化率不变
D.该反应的化学平衡常数K=[c(C)]2/c(A) ·c(B),且温度升高,K值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱图如下:
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。如下图A。
方法三:利用红外光谱仪测得A分子的红外光谱,如下图B。
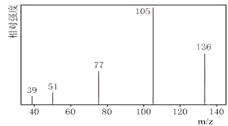
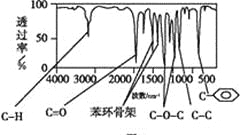
图A 图B
已知:A分子中只含有一个苯环,且苯环上只有一个取代基,试回答下列问题。
(1)分子中共有 种化学环境不同的氢原子。
(2)A的分子式为 。
(3)该物质属于哪一类有机物 。
(4)A的分子中只含一个甲基的依据是 (填序号)。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d .A分子的红外光谱图
(5)A的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.NaOH溶液能导电,所以NaOH溶液是电解质
B.固体KC1不导电,但KC1是电解质
C.氯水能导电,所以Cl2是电解质
D.C02的水溶液能导电,所以C02是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1) 电极X的材料是______;电解质溶液Y是________;
(2) 银电极为电池的 极,发生的电极反应式为 ;X电极上发生的电极反应为______反应;(填“氧化”或“还原”)
(3) 外电路中的电子 (填“流出”或“流向”)Ag电极。
(4) 当有1.6 g铜溶解时,银棒增重______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深人的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器___________。(填序号,下同);平衡常数最小的是容器_____________。
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中![]() 与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。

a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____,总反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷、乙烷、乙烯的叙述正确的是( )
A. 等质量的上述物质完全燃烧时耗氧量最多的是甲烷
B. 相同状况下,同体积的上述物质完全燃烧时耗氧量最多的是乙烯
C. 甲烷和乙烷不论以何种比例混合,只要总质量一定,完全燃烧生成的二氧化碳和水的质量也是定值
D. 在标准状况下,上述三种物质的混合物和足量氧气混合点燃,反应前后气体体积不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com