
(1)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分
搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(2)若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是 mol·L-1。
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列说法正确的是( )
A.乙烯和乙烷都能发生加聚反应
B.蛋白质水解的最终产物是多肽
C.米酒变酸的过程涉及了氧化反应
D.石油裂解和油脂皂化都是由高分子生成小分子的过程
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:填空题
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
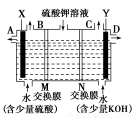
(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-1练习卷(解析版) 题型:选择题
结合下图判断,下列叙述正确的是( )
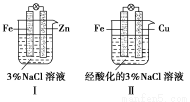
A.Ⅰ和Ⅱ中正极均保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-1练习卷(解析版) 题型:选择题
关于原电池的叙述正确的是( )
A.原电池工作时,电极上不一定都发生氧化还原反应
B.某可逆电池充、放电时的反应式为Li1-xNiO2+xLi LiNiO2,放电时此电池的负极材料是Li1-xNiO2
LiNiO2,放电时此电池的负极材料是Li1-xNiO2
C.铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1 120 mL(标准状况)气体析出
D.在理论上可将反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0设计成原电池
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-3练习卷(解析版) 题型:填空题
常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): 。
(2)混合溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是 (填序号)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:选择题
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的
CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
A.若pH>7,则一定是c1V1=c2V2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若V1=V2,则一定是c2>c1
D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-2练习卷(解析版) 题型:填空题
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)(正反应为放热反应)。现将一定
N2O4(g)(正反应为放热反应)。现将一定
量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:

(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com