
【题目】已知:CH4(g)+2O2(g)= CO2(g)+2H2O(l)ΔH=-Q1kJ/mol;
2H2(g)+O2(g)= 2H2O(g)ΔH =-Q2kJ/mol ;
2H2(g)+O2(g)= 2H2O(l)ΔH =-Q3kJ/mol。取体积比4:1的甲烷和H2的混合气112L(标况),完全燃烧后恢复到常温,放出热量为
A.4Q1+0.5Q3B.4Q1+0.5Q2C.4Q1+Q3D.4Q1+2Q2
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.0.1 mol C2H6O分子中含有C—H键数为0.5NA
B.0.1 mol Cl2和0.1 mol HI充分反应后气体分子数为0.2NA
C.CO2通过Na2O2使其增重2.8 g,反应中转移电子数为0.2NA
D.3.0 g甲醛(HCHO)和乙酸的混合物中含有的原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2→2NH3的能量变化如图所示,该反应的热化学方程式是 ( )
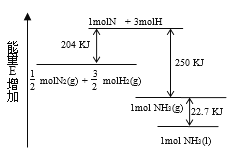
A.![]() N2(g)+
N2(g)+![]() H2(g)→ NH3(l) △H=-46kJ/mol
H2(g)→ NH3(l) △H=-46kJ/mol
B.![]() N2(g)+
N2(g)+ ![]() H2(g)→ NH3(g) △H=-454kJ/mol
H2(g)→ NH3(g) △H=-454kJ/mol
C.N2(g)+3H2(g)→2NH3(g) △H=-92kJ/mol
D.N2(g)+3H2(g)→2NH3(1) △H= +431.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
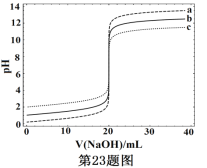
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-Q(Q>0)。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
N2(g)+2CO2(g)△H=-Q(Q>0)。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)写出该反应的平衡常数表达式____________________。
(2)前2s内的平均反应速率υ(N2)=__________;达到平衡时,CO的转化率为___________。
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液,往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,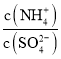 的值将_______(填 “变大”、“不变”或“变小”)。
的值将_______(填 “变大”、“不变”或“变小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作以及实验现象完全一致的是( )
A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
B | 向饱和碳酸钠溶液中通入过量 | 有白色固体析出 |
C | 将新制的氯水滴到蓝色石蕊试纸上 | 试纸变红 |
D | 将用砂纸打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落下来 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
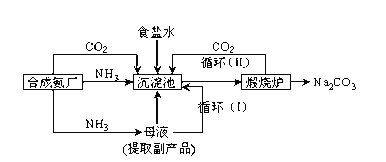
①沉淀池中反应的化学方程式:______;煅烧炉中发生的化学方程式:__________
②在常温下,向饱和Na2CO3的溶液中通入足量的CO2会有晶体析出,此晶体是NaHCO3。析出该晶体的原因是______________;在饱和的食盐水中先通入足量的氨,再通入足量的CO2,会有NaHCO3晶体析出,若在饱和的食盐水中先通入足量的CO2,再通入氨气,往往没有晶体析出,原因:______。
③检验产品碳酸钠中是否含有氯化钠的操作方法为:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com