

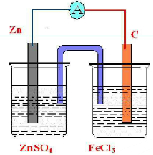
 ,
, .
.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、物质B可能为固态 |
| B、平衡向正反应方向移动 |
| C、B的转化率降低 |
| D、x的值大于等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液的体积大于氨水 |
| B、NaOH溶液的体积等于氨水 |
| C、NaOH溶液的体积小于氨水 |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含氧原子的物质的量的比为1:1 |
| B、所含硫原子的物质的量的比为1:1 |
| C、所含氧原子的质量为1:1 |
| D、SO2和SO3的质量为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
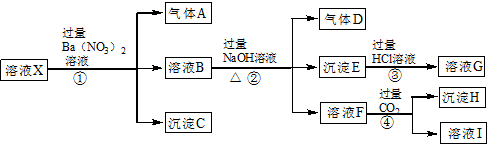
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在如图1用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
(1)在如图1用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②和④等体积混合后的溶液中离子浓度大小为:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | ||||||
B、②升高温度,
| ||||||
| C、pH相同的①和②,物质的量浓度关系:①>② | ||||||
| D、①和③以体积比2:5混合,所得溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com