
【题目】如图是可逆反应X2+3Y2 ![]() 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
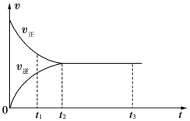
A. t1时,只有正方向反应
B. t2~t3,反应仍在进行
C. t2时,反应到达限度
D. t2~t3,各物质的浓度不再发生变化
科目:高中化学 来源: 题型:
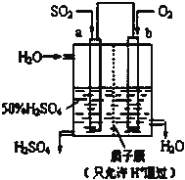
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示。下列说法正确的是

A. 电极b为电池负极
B. 电路中每流过4mol电子,正极消耗44.8LH2S
C. 电极b上的电极反应为:O2+4e-+4H+=2H2O
D. 电极a上的电极反应为:2H2S+2O2--4e-=S2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_____,b是_____极(填“正”或“负”),a电极反应式为_______,生产过程中H+向_____(填a或b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为_____,电解质溶液为_____。
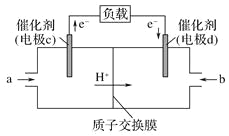
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)燃料电池的结构示意图如图:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____极(填“正”或“负”),c电极反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
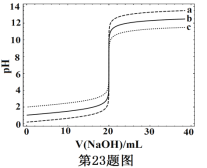
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。请回答:
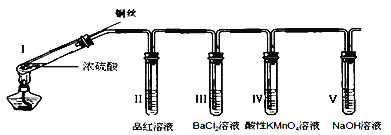
(1)下列说法正确的是__________。
A.反应后,将试管Ⅰ中的白色固体加入水中,溶液呈蓝色
B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4
C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性
D.试管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下述为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H1=akJ/mol
O2(g)=Cu2O(s)△H1=akJ/mol
②C(s)+![]() O2(g)=CO(g) △H2=bkJ/mol
O2(g)=CO(g) △H2=bkJ/mol
③Cu(s)+![]() O2(g)=CuO(s)△H3=ckJ/mol
O2(g)=CuO(s)△H3=ckJ/mol
则方法a中反应的热化学方程式是:_________________。
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O装置如图所示:
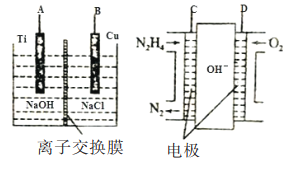
①如图装置中D电极应连______电极。(填“A”或“B”)
②该离子交换膜为______离子交换膜(填“阴”或“阳”),该电解池的B极反应式为:______。
③C极反应式为:__________。
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2(g)+O2(g) △H>0,水蒸气的浓度随时间t变化如表所示:
2H2(g)+O2(g) △H>0,水蒸气的浓度随时间t变化如表所示:
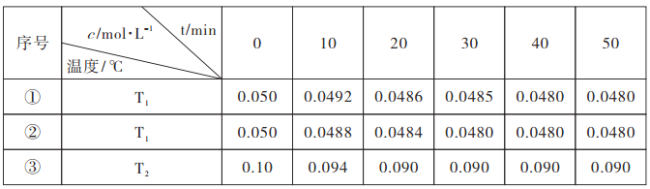
根据上述数据分析:
①催化剂的效率:实验①_______实验②(填“>”或“<”);
②通过实验①、③分析,T1______T2(填“>”或“<”);
③实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为18,中子数为10;X 和 Ne 的核外电子数相差1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
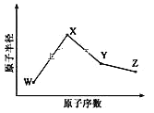
(1)X 元素位于元素周期表中位置为____________。
(2)Z 的同族简单氢化物中,稳定性最好的是________(写化学式),原因__________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为___________;X2W2的电子式为________。
(4)Y 与 Z 形成的化合物YZ4在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国中科院上海生化所于1982年5月合成了一种药物——脑啡肽,下面是它的结构简式。有关叙述正确的是( )

①脑啡肽为四肽化合物 ②组成脑啡肽的氨基酸共有4种R基
③一个脑啡肽完全水解所得氨基酸中共有5个游离的氨基
④反应物合成一个脑啡肽后,有机物中O原子减少了5个
A. ① B. ①④ C. ②③ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com