(2010?杭州一模)对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应原理的系列研究,请根据相关信息回答有关问题.
(1)关于反应生成物的定量研究:
已知反应:Br
2+2Fe
2+═2Br
-+2Fe
3+,向10mL 0.1mol?L
-1的FeBr
2溶液中通入0.001mol Cl
2,反应后,溶液中除含有Cl
-外,还一定
C
C
.(填字母序号)
A.含Fe
2+,不含Fe
3+B.含Fe
3+,不含Br
-C.含Fe
3+,含有Br
-(2)关于反应限度的研究:
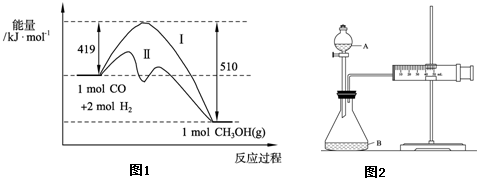
已知在773K、固定体积的容器中,反应CO(g)+2H
2(g)?CH
3OH(g)过程中能量变化如图1.曲线Ⅱ表示使用催化剂时的能量
变化.若投入a mol CO、2a mol H
2,平衡时能生成0.1a mol CH
3OH,反应就具工业应用价值.
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为
10%
10%
;
②在容器容积不变的前提下,欲提高H
2的转化率,可采取的措施(答两项即可):
增大CO浓度
增大CO浓度
、
适当降低温度或及时分离CH3OH
适当降低温度或及时分离CH3OH
;
(3)关于反应速率的研究:
氧化还原反应中实际上包含氧化和还原两个过程.下面是HNO
3发生 的一个还原过程的反应式:NO
3-+4H
++3e
-→NO+2H
2O
①KMnO
4、Na
2CO
3、CuO、KI四种物质中的
KI
KI
(填化学式)能使上述还原过程发生.
②欲用图2装置测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定
单位时间内收集的气体体积(或收集一定体积的气体所用的时间)
单位时间内收集的气体体积(或收集一定体积的气体所用的时间)
推(计)算反应速率.



