
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 酸性:HClO4>HNO3>H3PO4 | ||
| C. | 还原性:HCl>HBr>HI | D. | 碱性:NaOH>Mg(OH)2>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 酸分子中有几个H原子即为几元酸 | |
| D. | 盐电离时,只生成一种阳离子,一种阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气的热化学方程式是H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
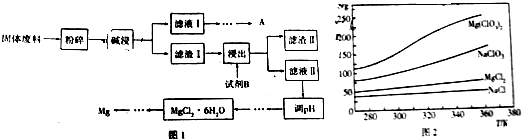
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的活泼性不如铁 | |
| B. | 铝与空气中的氧气不易发生化学反应 | |
| C. | 铝易在空气中形成致密的氧化膜 | |
| D. | 铝的密度比铁的密度小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com