
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
 H2(g)+CO2(g) △H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是 。
H2(g)+CO2(g) △H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是 。 CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol 
(1)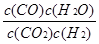 ; 放热;
; 放热;
(2)B、C;
(3)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
(4)CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH=-252.9kJ/mol
(5)O2+4e-+2CO2=2CO32- CO2 44.8
解析试题分析:(1)反应CO2(g) + H2(g)  CO(g) + H2O(g) 平衡常数表达式为
CO(g) + H2O(g) 平衡常数表达式为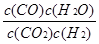 。由表格中数据可知,随着温度升高,平衡常数减少,说明正反应是放热反应。(2)容器容积固定,反应前后气体物质的量不变,所以无论是平衡状态还是非平衡状态,容器中压强均不变,A错误;化学平衡状态的标志是正、逆反应速率相等,各组分浓度保持不变,所以CO浓度保持不变的状态是平衡状态,B正确;H2和H2O的计量数比为1:1,所以v(H2)正= v(H2O)逆的状态是平衡状态,C正确;二氧化碳与一氧化碳浓度相等不能作为判断反应是平衡状态的标志,平衡时二者浓度可能相等也可能不等,与二氧化碳起始投料和二氧化碳的转化率有关系,D错误。(3)CO2与NaOH反应有两种情况:CO2+2NaOH=Na2CO3+H2O、NaOH+CO2=NaHCO3,题中CO2与NaOH物质的量比为2:3,介于1:1与1:2之间,所以1molCO2与1.5molNaOH生成Na2CO3和NaHCO3,设Na2CO3、NaHCO3物质的量分别为x、y,由C守恒得x+y=1;由Na守恒得2x+y=1.5,解得x=y=0.5mol。CO32-水解生成HCO3-和OH-,所以溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。(4)CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH=4ΔH2-ΔH1=-252.9 kJ/mol。(5)电池中介质为熔融碳酸盐,正极通入的是氧气,正极反应为O2+4e-=2O2-、O2-+CO2=CO32-,将二式相加即得O2+4e-+2CO2=2CO32-。由电极反应可知图中的A为CO2。由正、负极电子转移相等得CH4~8e-~2O2,所以通入的O2为4mol时反应的CH4为2mol。
。由表格中数据可知,随着温度升高,平衡常数减少,说明正反应是放热反应。(2)容器容积固定,反应前后气体物质的量不变,所以无论是平衡状态还是非平衡状态,容器中压强均不变,A错误;化学平衡状态的标志是正、逆反应速率相等,各组分浓度保持不变,所以CO浓度保持不变的状态是平衡状态,B正确;H2和H2O的计量数比为1:1,所以v(H2)正= v(H2O)逆的状态是平衡状态,C正确;二氧化碳与一氧化碳浓度相等不能作为判断反应是平衡状态的标志,平衡时二者浓度可能相等也可能不等,与二氧化碳起始投料和二氧化碳的转化率有关系,D错误。(3)CO2与NaOH反应有两种情况:CO2+2NaOH=Na2CO3+H2O、NaOH+CO2=NaHCO3,题中CO2与NaOH物质的量比为2:3,介于1:1与1:2之间,所以1molCO2与1.5molNaOH生成Na2CO3和NaHCO3,设Na2CO3、NaHCO3物质的量分别为x、y,由C守恒得x+y=1;由Na守恒得2x+y=1.5,解得x=y=0.5mol。CO32-水解生成HCO3-和OH-,所以溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。(4)CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH=4ΔH2-ΔH1=-252.9 kJ/mol。(5)电池中介质为熔融碳酸盐,正极通入的是氧气,正极反应为O2+4e-=2O2-、O2-+CO2=CO32-,将二式相加即得O2+4e-+2CO2=2CO32-。由电极反应可知图中的A为CO2。由正、负极电子转移相等得CH4~8e-~2O2,所以通入的O2为4mol时反应的CH4为2mol。
考点:化学平衡常数 化学平衡状态的标志 离子浓度比较 盖斯定律 电化学
点评:本题(5)也可先写出燃料电池总反应CH4+2O2=CO2+2H2O,用总反应减去负极电极反应式即得正极电极反应式。


科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源:2011届浙江省杭州高级中学高三高考全真模拟卷(理综)化学试题 题型:填空题
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式:______________________。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式:
__________________________________________________________________________。
(3)在T1℃时,将5 mol N2O5置于10 L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①上述平衡体系中O2的体积分数为__________,N2O5的物质的量为__________mol。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= __________。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有__________。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
查看答案和解析>>
科目:高中化学 来源:2014届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:填空题
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式: 。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式: 。
(3)在T1℃时,将5 mol N2O5置于10L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①求该反应的平衡常数K= (数字代入式子即可),上述平衡体系中O2的体积分数为__________。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= 。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有 。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大 C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:
2SO2+O2 ![]() 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容
器中放入起始物质,平衡时SO3的物质的量可能大于n的是 ( )
A.2 mol SO2 + 1 mol O2 B.4 mol SO2 + 1 mol O2
C.2 mol SO2 + 1 mol O2 + 2 SO3 D.3 mol SO2 + 1 SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com