
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为____________个;
(2)该气体在标准状况下的体积为____________L;
(3)该气体每个分子的质量为_______________g;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
【答案】2mNA/M 22.4m/M M/NA m/MV
【解析】
(1)根据n=m/M及N=nNA计算分子数目,含有原子数目为分子的2倍;
(2)根据n=m/M及V=nVm计算气体体积;
(3)根据n=m/M及N=nNA计算一个分子的质量;
(4)根据c=n/V计算。
(1)该气体的物质的量为![]() =
=![]() mol,因为一个分子中含两个原子,该气体所含原子总数为
mol,因为一个分子中含两个原子,该气体所含原子总数为![]() ×2×NA=2mNA/M;
×2×NA=2mNA/M;
因此,本题正确答案是:2mNA/M;
(2)该气体的物质的量为![]() =
=![]() mol,该气体在标准状况下的体积为
mol,该气体在标准状况下的体积为![]() ×Vm=(m/M) ×22.4=22.4m/M L;
×Vm=(m/M) ×22.4=22.4m/M L;
因此,本题正确答案是:22.4m/M ;
(3)NA个该气体的分子质量总和为Mg,每个分子的质量为M/NAg;
因此,本题正确答案是:M/NA;
(4)根据c=n/V可知,该气体溶于水后形成VL溶液,其溶液的物质的量浓度为![]() /V= m/MV mol/L;
/V= m/MV mol/L;
因此,本题正确答案是:m/MV。


科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A. 锂、钠、钾各1 g,分别与足量的水反应,最剧烈的是锂
B. 锂、钠、钾各1 g,分别与足量的水反应,产生氢气质量最大的是锂
C. 锂、钠、钾各1 g,其中所含原子数最多的是锂
D. 锂、钠、钾失电子能力最强的是钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水体中部分含氮有机物循环如图1所示.
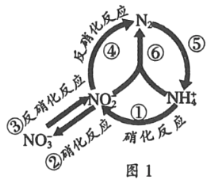
(1)图中属于氮的固定的是____ (填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJmol﹣1
则反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=____kJmol﹣1
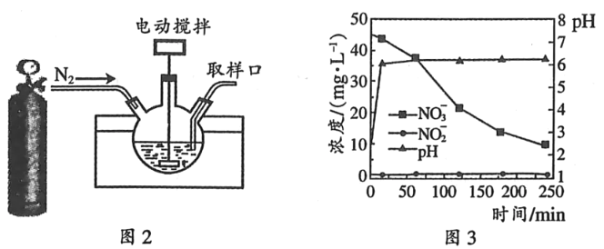
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3﹣,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3﹣起始浓度为45mgL﹣1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3﹣、NO2﹣及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为____.
②向三颈烧瓶中通入N2的目的是____.
③开始反应0~20min,pH快速升高到约6.2,原因之一是___________;NO3﹣还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___
(4)一种可以降低水体中NO3﹣含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
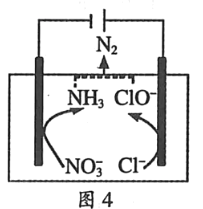
①电解时,阴极的电极反应式为_____.
②溶液中逸出N2的离子方程式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下图中序号①~④仪器的名称:
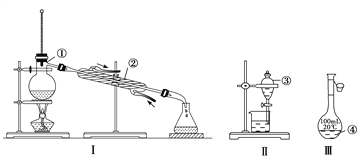
①___________;②___________; ③___________; ④___________。
(2)仪器①~④中,使用时必须检查是否漏水的有__________(填仪器序号)。
(3)右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol·L-l的稀硫酸。

可供选用的仪器有: ①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
①配制稀硫酸时,还缺少的仪器有__________、__________(写仪器名称)。
②经计算,配制480 mL l mol·L-l的稀硫酸需要用量筒量取上述浓硫酸的体积为________mL。将量取好的浓硫酸缓慢注入到盛水的烧杯后,发现量筒里还残留有浓硫酸,如果用蒸馏水洗涤后一并将洗涤液注入烧杯,将使结果浓度______(填“偏高”“偏低”或“无影响”)。
③在转入容量瓶前烧杯中液体应_______,否则会使结果浓度____(填“偏高”“偏低”或“无影响”)。
④定容时必须使溶液的凹液面与刻度线相平,若俯视会使浓度______。(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应A(g)+B(g)![]() C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
A. 等于10 sB. 大于10 sC. 小于10 sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿渣主要含硫酸钡、氧化铜、氧化铝等(杂质不参加反应),利用矿渣提取金属的工艺流程如图所示(乙、丙、丁、戊均为单质):

回答下列问题:
(1)沉淀①为_____________(填“强”、“弱”或“非”)电解质。
(2)灼烧沉淀②所需要的非玻璃仪器有坩埚、__________、___________、__________。
(3)滤液①的主要成分为___________________________。
(4)滤液①中加入适量盐酸发生的离子方程式为_______________、__________________。
(5)反应①的反应条件是________________________。
(6)电解滤液③时阴极的电极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于烧杯中,加入250 mL蒸馏水溶解,然后转移至250 mL容量瓶中定容 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | SO42-的检验 | 先滴加BaCl2溶液再滴加HCl溶液生成白色沉淀证明原溶液中有SO42- |
D | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。 | 溶液中一定含有Fe2+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是

A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中c (HCO3-) > c (CO32-)
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com