
(1)某温度下,纯水中c [H+]=2.0×10-7 mol/L,则此时c [OH-] = mol/L,水的离子积Kw= ;相同条件下,测得① Na2CO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
(2)pH值相同的 HCl(aq)、H2SO4(aq)、 CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 ;
②分别用0.1 mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是 。
③反应开始时,反应速率 。(从下面选项中选择填写)
| A.HCl最快; | B.H2SO4最快; | C.CH3COOH最快; | D.一样快 |
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数(mol2·L-2) | 1×10-14 | a | 1×10-12 |
(16分)(1)2.0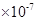 4.0
4.0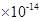 ②
② ①
① ③
③
(2)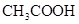
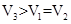 D (3)
D (3)
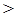
(4)pH >7 (1分) CO32- + H2O  HCO3- + OH- (1分)
HCO3- + OH- (1分)
2Al3+ + 3CO32- + 3H2O ="=" 2Al(OH)3↓+ 3CO2↑ (1分)
(5)①水是弱电解质,存在电离平衡,电离是吸热的,加热促进电离。
②1000:1 ③9:11;c (Na+) >c(SO42-)>c (H+) >c (OH-)。
解析试题分析:(1)纯水是显中性的,则c [H+]=c [OH-] =2.0×10-7 mol/L,水的离子积Kw=" c" [H+]·c [OH-]=4.0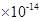 。酸性越弱,相应的钠盐越容易水解,溶液的碱性就越强。酸性是醋酸>碳酸>次氯酸。所以如果测得① Na2CO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是②
。酸性越弱,相应的钠盐越容易水解,溶液的碱性就越强。酸性是醋酸>碳酸>次氯酸。所以如果测得① Na2CO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是② ①
① ③。
③。
(2)①盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,所以在pH相同的条件下,三种溶液中物质的量浓度最大的是醋酸。
②硫酸和盐酸中氢离子的物质的量相同,消耗的氢氧化钠相等,醋酸消耗的氢氧化钠最多。
③反应开始时,氢离子浓度相同,反应速率一样快,答案选D。
(3)①根据电荷守恒可知c (Na+) +c (H+) = c( CN-)+c (OH-),所以如果溶液中c (Na+) > c( CN-),则溶液中c (OH-)>c (H+)。
②根据①可知溶液显碱性,这说明水解程度大于电离程度,所以c (HCN)>c (CN-)。
(4)①碳酸钠是强碱弱酸盐,水解显碱性,水解方程式是CO32- + H2O  HCO3- + OH-。
HCO3- + OH-。
②CO32-水解显碱性,Al3+水解显酸性,二者相互促进生成氢氧化铝白色沉淀和CO2气体,反应的方程式是2Al3+ + 3CO32- + 3H2O ="=" 2Al(OH)3↓+ 3CO2↑。
(5)①水是弱电解质,存在电离平衡,电离是吸热的,如果25<t1<t2,则a>1×10-14 mol2·L-2。
②如果硫酸钠溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是2×5×10-4 mol/L。稀释10倍后c(Na+)=1×10-4 mol/L,而硫酸钠溶液是显中性的,所以稀释后溶液中c(Na+)∶c(OH-)=1000:1。
③所得混合溶液的pH=2,则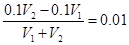 ,解得V1∶V2=9:11。溶液中各种离子的浓度由大到小的顺序是c (Na+) >c(SO42-)>c (H+) >c (OH-)。
,解得V1∶V2=9:11。溶液中各种离子的浓度由大到小的顺序是c (Na+) >c(SO42-)>c (H+) >c (OH-)。
考点:考查外界条件对水的电离平衡影响、溶液酸碱性、溶液中离子浓度大小比较、盐类水解以及pH的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固,同时兼顾对学生能力的培养和方法的指导与训练。有利于培养学生的逻辑推理能力和规范的答题能力,提高学生的应试能力,调动学生的学习兴趣和学习积极性。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西师大附中高二(上)期中化学试卷(解析版) 题型:填空题
 O2(g)═H2O(g)△H2=-242.0kJ/mol
O2(g)═H2O(g)△H2=-242.0kJ/mol O2(g)═CO2(g)△H3=-283.0kJ/mol
O2(g)═CO2(g)△H3=-283.0kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com