
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 ①含有孤电子对和含有空轨道的原子之间易形成配位键,一方提供空轨道,另一方提供孤对电子;
②因S、P能级的电子云形状不同,所以s-s σ键与s-p σ键的电子云形状不同;
③根据原子核外电子最后排入的电子名称确定元素在周期表中所属区名称;
④非极性分子往往是高度对称的分子,比如BF3,PCl5,CO2这样的分子,H2O2是极性分子;
⑤氢键不是化学键;
⑥氢氧化铜能和酸发生中和反应,也能和氨水反应生成络合物;
⑦HgCl2的稀溶液有弱的导电能力,说明是弱电解质;
⑧中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体.
解答 解:①配位键在形成时,含有孤电子对的原子提供电子、含有空轨道的原子提供轨道,二者形成配位键,故①错误;
②S能级电子云是球形,P能级电子云是哑铃型,所以s-s σ键与s-p σ键的电子云形状不同,故②错误;
③根据最后排入电子名称确定元素在周期表中所属区名称,Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]3d104s24p2,属于P区元素,故③错误;
④H2O2结构为 ,结构不对称,属于极性分子,故④错误;
,结构不对称,属于极性分子,故④错误;
⑤冰中存在极性共价键和氢键两种作用,但氢键不是化学键,故⑤错误;
⑥氢氧化铜能和硝酸、浓硫酸发生中和反应,溶于硝酸、浓硫酸,氢氧化铜能和氨水反应生成络合物离子银氨离子,所以氢氧化铜能溶于氨水中,故⑥正确;
⑦HgCl2的稀溶液有弱的导电能力,可作手术刀的消毒液,是电离出的汞离子使蛋白质变性,说明其是弱电解质,故⑦错误;
⑧中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,故⑧正确;
故选B.
点评 本题考查了化学键的有关知识,涉及配位键、氢键、杂化理论的应用等,知道配位键的形成、氢键不是化学键、过氧化氢的结构等基础知识是解答关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应时都伴随着能量变化,伴随着能量变化的变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 | |
| D. | 因为石墨变成金刚石吸热,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{49}^{115}$In原子核外有49个电子 | |
| B. | ${\;}_{49}^{115}$In原子核内有49个中子 | |
| C. | ${\;}_{49}^{115}$In原子核内质子数和中子数之和等于其质量数,为115 | |
| D. | ${\;}_{49}^{115}$In是In元素的一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
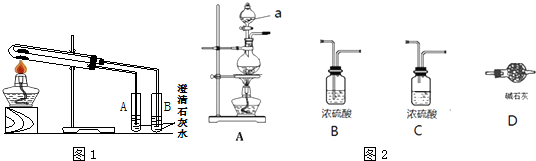
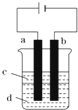 Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.
Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都含有卤原子 | |
| B. | 所有卤代烃都是通过取代反应制得的 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是难溶于水,密度比水小的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 气体 | 除杂试剂 |
| A | CO2(HCl) | 盛饱和NaHCO3溶液的吸气瓶 |
| B | Cl2(HCl) | 盛饱和食盐水的吸气瓶 |
| C | NH3(H2O) | 盛碱石灰的球形干燥管 |
| D | SO2(HCl) | 盛饱和AgNO3溶液的吸气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
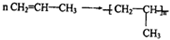 ,该反应的反应类型为加聚反应.
,该反应的反应类型为加聚反应.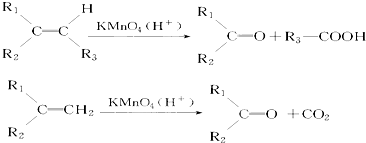
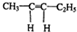 .若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(
.若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(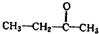 ),则此烯烃的结构简式为
),则此烯烃的结构简式为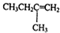 ,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.
,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com